题目内容
6.依据原子结构知识回答:(1)Si基态原子的电子排布式是1s22s22p63s23p2;S的价层电子排布式3s23p4.
(2)基态的26Fe原子有4个未成对电子,Fe2+的外围电子排布图
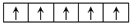 .
.(3)四种元素(Cu、K、O、F)中第一电离能最小的是K,电负性最大的是F.
(4)下列有关微粒性质的排列顺序中,错误的是B
A.元素的电负性:P<O<F B.元素的第一电离能:C<N<O
C.离子半径:O2->Na+>Mg2+ D.原子的未成对电子数:Mn>Si>Cl.
分析 (1)Si元素为14号元素,原子核外有14个电子;S元素为16号元素,原子核外有16个电子;
(2)Fe基态原子电子排布式1s22s22p63s23p63d64s2;Fe元素的价电子为3d和4s上电子,根据构造原理书写其价电子排布式;
(3)元素的金属性越强,其第一电离能越小;元素的非金属性越强,其电负性越强;
(4)A.得电子能力越强,电负性越大;
B.元素的第一电离能和最外层电子数的多少有关,轨道处于全充满和半充满状态稳定;
C.电子层越多,半径越大,电子层一样多的微粒,核电荷数越多半径越小;
D.根据原子轨道上电子的排布来确定未成对电子数.
解答 解:(1)Si元素为14号元素,原子核外有14个电子,则核外电子排布式为:1s22s22p63s23p2;S元素为16号元素,原子核外有16个电子,所以核外电子排布式为:1s22s22p63s23p4,则S的价层电子排布式3s23p4;
故答案为:1s22s22p63s23p4;3s23p4;
(2)Fe为26号元素,原子核外有26个电子,Fe基态原子电子排布式1s22s22p63s23p63d64s2,则原子有4个未成对电子;Fe元素的价电子为3d和4s上电子,亚铁离子核外有24个电子,根据构造原理知,Fe2+的外围电子排布式为3d6,其外围电子排布图为 ,
,
故答案为:4; ;
;
(3)元素的金属性越强,其第一电离能越小,则四种元素(Cu、K、O、F)中K的第一电离能最小;元素的非金属性越强,其电负性越强,所以F的电负性最大;
故答案为:K;F;
(4)A.得电子能力P<O<F,所以元素的电负性P<O<F,故A正确;
B.C的电子排布式:1s22s22p2,N的电子排布式:1s22s22p3,p轨道处于半充满状态,O的电子排布式:1s22s22p4,第一电离能应该是N的最大,则元素的第一电离能:C<O<N,故B错误;
C.这些离子是电子层一样多的微粒,根据核电荷数越多半径越小,则离子半径:O2->Na+>Mg2+,故C正确;
D.Mn、Si、Cl原子的未成对电子数分别为5、2、1,即原子的未成对电子数:Mn>Si>Cl,故D正确.
故答案为:B.
点评 本题考查了电子排布式和电子排布图、第一电离能、电负性、离子半径的比较等,题目难度中等,注意元素的金属性、非金属性与元素性质的递变规律,侧重原子结构及性质的考查.

 阅读快车系列答案
阅读快车系列答案| A. | 1H、D+、T2互为同位素 | |
| B. | 金属单质都能导电,非金属单质都不能导电 | |
| C. | 非金属元素最高价氧化物的水化物并不一定都具有强氧化性 | |
| D. | 非金属氧化物不一定是酸性氧化物,而金属氧化物一定是碱性氧化物 |
| A. | 0.01mol•L-1 | B. | 0.04mol•L-1 | C. | 0.08mol•L-1 | D. | 0.16mol•L-1 |
| 主族族数 周期序数 | ||||||||
| ⑤ | ⑥ | ⑧ | ||||||
| ① | ③ | ④ | ⑦ | ⑩ | ||||
| ② | ⑨ |
(2)①、③两元素的氧化物对应的水化物中碱性强的是NaOH;(填化学式,下同.)⑤、⑦两元素的最高价氧化物对应的水化物中酸性强的是H2SO4,用一个化学方程式证明Na2CO3+H2SO4=CO2↑+Na2SO4+H2O.
(3)①、②、③三元素按原子半径由小到大的顺序排列为Mg<Na<K.
(4)写出由②、⑨两元素组成物质的电子式
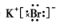 .
.(5)①的氧化物对应的水化物与④的氯化物反应的离子方程式,因物质的量配比不同产物有所不同,试分别写出有关反应的离子方程式Al3++3OH-=Al(OH)3↓、Al3++4OH-=AlO2-+2H2O.
| A. | 4.6g金属钠变成Na+,失去的电子数为0.2NA | |
| B. | 1.0L 1mol/L NaOH水溶液中含有的氧原子数为NA | |
| C. | 17g NH3所含的电子数为10NA | |
| D. | 9.5g MgCl2 溶于水所得溶液中含Cl-数为0.2NA |
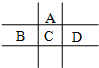 有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素在周期表中的位置如图所示,其中C元素的最高价氧化物对应的水化物浓溶液是一种常见的干燥剂.D在海水中大量富集.E的氧化物是两性氧化物,回答下列问题:
有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素在周期表中的位置如图所示,其中C元素的最高价氧化物对应的水化物浓溶液是一种常见的干燥剂.D在海水中大量富集.E的氧化物是两性氧化物,回答下列问题: