题目内容
19.NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 1 L 0.1mol/L NaHSO3溶液中含有HSO3-离子数为0.1NA | |
| B. | 50 mL 18.4 mol•L-1浓硫酸与足量铜反应,生成SO2分子数为0.46 NA | |
| C. | 1 mol H2和1 mol I2充分反应,可得到HI分子数为2NA | |
| D. | 2.2 g CO2与足量镁粉反应,转移电子数为0.2NA |
分析 A、HSO3-在溶液中既能电离又能水解;
B、铜只能与浓硫酸反应,和稀硫酸不反应;
C、氢气和碘的反应为可逆反应;
D、求出二氧化碳的物质的量,然后根据二氧化碳和镁反应后由+4价变为0价来分析.
解答 解:A、HSO3-在溶液中既能电离又能水解,故溶液中HSO3-的个数小于0.1NA个,故A错误;
B、铜只能与浓硫酸反应,和稀硫酸不反应,故浓硫酸不能完全反应,则生成的二氧化硫分子个数小于0.46NA个,故B错误;
C、氢气和碘的反应为可逆反应,故不能进行彻底,则生成的HI分子个数小于2NA个,故C错误;
D、2.2g二氧化碳的物质的量为0.05mol,而二氧化碳和镁反应后由+4价变为0价,故0.05mol二氧化碳反应后转移0.05mol×4=0.2mol电子,极转移0.2NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
5.下列大小比较不正确的是( )
| A. | 熔沸点:S<NaCl<SiO2 | |
| B. | 酸性:HNO2<HNO3;H3PO4<H2SO4 | |
| C. | 键角:H2O中H-O-H<NH3中H-N-H<CH4中H-C-H | |
| D. | 键长:C-H<O-H |
7.下列关于元素性质的有关叙述中不正确的是( )
| A. | S Cl 的原子半径依次减小 | |
| B. | Na Mg 的失电子能力依次增强 | |
| C. | O F的气态氢化物的稳定性依次增强 | |
| D. | Si P 的最高价含氧酸的酸性依次增强 |
14.下列变化中,属于加成反应的是( )
| A. | 乙炔通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色 | |
| B. | 甲苯在一定条件下与浓硝酸反应生成三硝基甲苯 | |
| C. | 乙醇在一定条件下与氢溴酸反应生成溴乙烷 | |
| D. | 在一定条件下苯与氢气反应制取环己烷 |
4.根据转化关系判断下列说法正确的是( )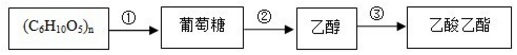

| A. | 反应②的反应类型属于分解反应 | |
| B. | (C6H10O5)n可以是淀粉或纤维素,二者互为同分异构体 | |
| C. | 将烧黑的铜丝趁热插入乙醇中可得到乙酸 | |
| D. | 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯 |
11. X、Y、Z、W均为短周期主族元素,其最高价氧化物对应水化物(常温下,浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是
X、Y、Z、W均为短周期主族元素,其最高价氧化物对应水化物(常温下,浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是
( )
 X、Y、Z、W均为短周期主族元素,其最高价氧化物对应水化物(常温下,浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是
X、Y、Z、W均为短周期主族元素,其最高价氧化物对应水化物(常温下,浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是( )
| A. | 简单离子半径:W>Z>Y>X | B. | 简单氢化物稳定性:X>Z>W | ||
| C. | 制造镁合金时可以用X2作保护气 | D. | 化合物Y2Z2中存在离子键和共价键 |
8.几种短周期元素的原子半径及主要化合价如表:已知X是短周期中最活泼的金属,且与R同周期.(请用化学用语答题)
(1)R的元素符号为Al; M在元素周期表中的位置为第二周期第VIA族.
(2)X与Y按原子个数比1:1构成的物质的电子式为 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.
(3)X+,Y2?,M2?离子半径大小顺序为S2?>O2?>Na+;.
(4)将YM2通入FeCl3溶液中的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式Cu+2OH--2e-=Cu(OH)2.
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
(2)X与Y按原子个数比1:1构成的物质的电子式为
 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.(3)X+,Y2?,M2?离子半径大小顺序为S2?>O2?>Na+;.
(4)将YM2通入FeCl3溶液中的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式Cu+2OH--2e-=Cu(OH)2.
9.X、Y、Z、W是处于相邻短周期的不同主族元素.已知:四种元素的最外层电子数之和为13;X的单质常温下能与水剧烈反应;W的单质是黑火药的主要成分之一,它的一种氧化物有毒,易溶于水;Z的原子半径小于W;Z的最外层电子数是Y最外层电子数的2倍.下列说法正确的是( )
| A. | 含氧酸的酸性、氢化物的沸点:W>Z | |
| B. | 原子半径:X>Y>W | |
| C. | X的氢化物、X2W溶于水后所得溶液都呈碱性 | |
| D. | Z的最高价氧化物常用作光导纤维 |