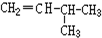题目内容
2.设NA伏加徳罗常数的值.下列叙述错误的是( )| A. | 标准状况下,22.4 L CH4中含有分子的数目为NA | |
| B. | 标准状况下,2.24 L Cl2与足量铁反应,转移电子的数目为0.3NA | |
| C. | 常温常压下,46 g NO2和N2O4混合气体中含有的原子数为3NA | |
| D. | 标准状况下,2.24 LCO2与足量镁反应,转移电子的数目为0.4NA |
分析 A、根据气体的分子数N=$\frac{V}{Vm}$NA;
B、根据氯气和铁反应后变为-1价来分析;
C、NO2和N2O4化学式最简比相同,只需计算46gNO2和中所含的原子数即可;
D、求出二氧化碳的物质的量,然后根据与镁反应后碳元素变为0价来分析;
解答 解:A、标况下,22.4L甲烷中含有的甲烷气体的分子数N=$\frac{V}{Vm}$NA=$\frac{22.4L}{22.4L/mol}$NA=NA,故A正确;
B、标况下,2.24L氯气的物质的量为0.1mol,而反应后氯元素为-1价,则1mol氯气转移2mol电子,故0.1mol氯气转移0.2mol电子即0.2NA个,故B错误;
C、N02和N204的最简式均为NO2,故46g混合物中含有的NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,则混合气体中含有3mol原子即3NA个,故C正确;
D、标况下,2.24L二氧化碳的物质的量为0.1mol,与镁反应后碳元素变为0价,则1mol二氧化碳转移4mol电子,故0.1mol二氧化碳转移0.4mol电子即0.4NA个,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数数的有关计算,掌握公式的应用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
12.下列物质前者是强电解质、后者是弱电解质的是( )
| A. | KNO3 CH3COOH | B. | HCl NaHSO4 | C. | NaCl BaSO4 | D. | NH3•H2O H2SO4 |
13.下列各组中两个反应的反应热,其中△H1>△H2( )
| A. | 2H2(g)+O2(g)═2H2O(g)△H1;2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2 | |
| C. | 2SO2(g)+O2(g)═2SO3(g)△H1;2SO3(g)═O2(g)+2SO2(g)△H2 | |
| D. | 已知反应:C(金刚石,s)═C(石墨,s)△H<0,C(金刚石,s)+O2(g)═CO2(g)△H1;C(石墨,s)+O2(g)═CO2(g)△H2 |
7.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.图为N2(g)和O2(g)生成NO(g)过程中的能量变化,下列说法中正确的是( )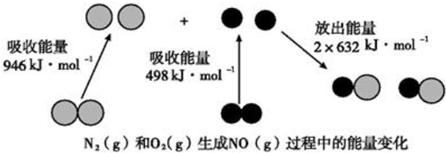

| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180kJ | |
| B. | 1mol N2(g)和1mol O2(g)具有的总能量小于2molNO(g)具有的总能量 | |
| C. | 该反应中反应物断开化学键所吸收的总能量小于生成物形成化学键所释放出的总能量 | |
| D. | 恒容密闭容器中,充入Ar气,该反应速率加快 |
14.海水是巨大的资源宝库,海水中主要离子的含量如表所示.
从海水中提取食盐和溴的工艺流程如图:
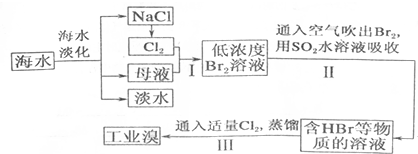
(1)请列举海水淡化的一种方法蒸留法或电渗透法或离子交换法等.
(2)请写出步骤I反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
(3)步骤I中已经获得Br2,步骤II中又将获得的Br2还原为Br-,其目的是富集溴元素.
(4)步骤II用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为SO2+Br2+2H2O═4H++2Br-+SO42-.
(5)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2的溶解)
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |

(1)请列举海水淡化的一种方法蒸留法或电渗透法或离子交换法等.
(2)请写出步骤I反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
(3)步骤I中已经获得Br2,步骤II中又将获得的Br2还原为Br-,其目的是富集溴元素.
(4)步骤II用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为SO2+Br2+2H2O═4H++2Br-+SO42-.
(5)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2的溶解)
11.世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成生石灰;
②在海水中加入生石灰,过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤;
④在氯化氢热气流中加热晶体;
⑤电解上述所得盐(熔融条件下).
下列说法正确的是( )
①把贝壳制成生石灰;
②在海水中加入生石灰,过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤;
④在氯化氢热气流中加热晶体;
⑤电解上述所得盐(熔融条件下).
下列说法正确的是( )
| A. | 向洗涤液中滴加氯化钙溶液可检验沉淀是否洗涤干净 | |
| B. | 上述变化过程中包括了分解、化合、复分解、置换等四种反应类型 | |
| C. | 步骤④在氯化氢热气流中加热晶体的目的是为了防止氯化镁水解 | |
| D. | 步骤⑤也可以采用电解该盐水溶液的方法 |
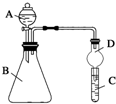 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.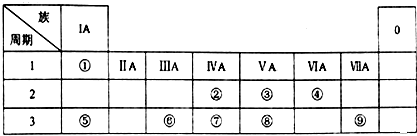
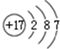 .
.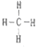 ⑧的最高价氧化物的水化物的分子式H3PO4.
⑧的最高价氧化物的水化物的分子式H3PO4. .
. 和
和 F.
F. 和CH2=CH-CH3G.
和CH2=CH-CH3G.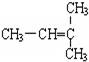 和
和