题目内容
12.下列物质前者是强电解质、后者是弱电解质的是( )| A. | KNO3 CH3COOH | B. | HCl NaHSO4 | C. | NaCl BaSO4 | D. | NH3•H2O H2SO4 |
分析 电解质的强弱是根据电离程度划分的,在水溶液里或熔融状态下完全电离是电解质是强电解质,部分电离是电解质是弱电解质,强酸、强碱和大部分的盐属于强电解质,据此进行解答.
解答 解:A.硝酸钾是强电解质,醋酸是弱电解质,故A正确;
B.HCl NaHSO4都是强电解质,故B错误;
C.NaCl、BaSO4都属于强电解质,故C错误;
D.一水合氨是弱电解质,硫酸是强电解质,故D错误;
故选A.
点评 本题考查了强弱电解质的判断,题目难度不大,明确电解质的强弱划分依据为解答关键,注意掌握强弱电解质的概念及判断方法,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
2.用碳棒作电极电解下列物质的水溶液,一段时间后,加入适量括号内物质,可使溶液恢复原溶质原浓度的是( )
| A. | NaCl (NaCl ) | B. | MgSO4(MgO) | C. | CuSO4(CuO) | D. | CuCl2(CuCl2) |
20.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 一定温度下,pH=6的纯水中含有OH-的数目为10-6NA | |
| B. | 120 g NaHSO4固体中含有的离子总数为2NA | |
| C. | 标准状况下,22.4 L己烷中所含分子的数目为NA | |
| D. | 100 mL 0.5 mol•L-1的(NH4)2SO4溶液中,NH4+的数目为0.1NA |
4.乙烯、乙炔、邻二甲苯相比较,下列叙述不正确的是( )
| A. | 都能燃烧,生成 CO2 和 H2O | |
| B. | 邻二甲苯另有三种属于芳香烃的同分异构体 | |
| C. | 乙烯和乙炔易发生加成反应,邻二甲苯能发生取代反应 | |
| D. | 乙烯和乙炔易使酸性 KMnO4 溶液褪色,而邻二甲苯不能 |
2.设NA伏加徳罗常数的值.下列叙述错误的是( )
| A. | 标准状况下,22.4 L CH4中含有分子的数目为NA | |
| B. | 标准状况下,2.24 L Cl2与足量铁反应,转移电子的数目为0.3NA | |
| C. | 常温常压下,46 g NO2和N2O4混合气体中含有的原子数为3NA | |
| D. | 标准状况下,2.24 LCO2与足量镁反应,转移电子的数目为0.4NA |
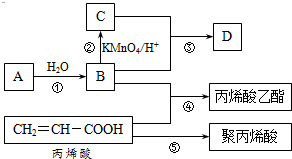 A、B、C、D是四种常见的有机物,其中A是一种气态烃,在标准状况下的密度为1.25g/L;B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示v(反应条件已省略):
A、B、C、D是四种常见的有机物,其中A是一种气态烃,在标准状况下的密度为1.25g/L;B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示v(反应条件已省略): ,C中官能团的名称为羧基.
,C中官能团的名称为羧基. ,加聚反应.
,加聚反应.