题目内容
2.下列各组物质中,属于同位素的是(填序号,下同)B,属于同素异形体的是A,互为同系物的是F,属于同分异构体的是CG,属于同种物质的是DE.A.O2和O3 B.D和T C.CH3CH2CH2CH3和CH3CH(CH3)2D.CH3CH2CH2CH(C2H5)CH3和CH3CH2CH2CH(CH3)CH2CH3E.
 和
和 F.
F. 和CH2=CH-CH3G.
和CH2=CH-CH3G.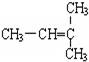 和
和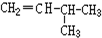
分析 质子数相同,质量数(或中子数)不同的原子互称同位素;
同种元素形成的不同单质互为同素异形体;
同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团的化合物,官能团数目和种类相等;
具有相同分子式而结构不同的化合物互为同分异构体;
组成和结构都相同的物质为同一物质,同一物质组成、结构、性质都相同,结构式的形状及物质的聚集状态可能不同.
解答 解:A.O2和O3都是由氧元素形成的不同单质,故互为同素异形体;
B.D和T质子数相同,中子数不同,故互为同位素;
C.CH3CH2CH2CH3和CH3CH(CH3)2分子式相同,但结构不同,故互为同分异构体;
D.CH3CH2CH2CH(C2H5)CH3和CH3CH2CH2CH(CH3)CH2CH3是同一物质,
E. 是同一物质;
是同一物质;
F. 结构相似,分子组成相差2个“CH2”原子团,故互为同系物;
结构相似,分子组成相差2个“CH2”原子团,故互为同系物;
G. 分子式相同,但结构不同,故互为同分异构体;
分子式相同,但结构不同,故互为同分异构体;
故答案为:B;A;F;CG;DE.
点评 本题考查同位素、同素异形体、同系物、同分异构体、同一物质的区别,难度不大,注意把握概念的内涵与外延.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.设NA伏加徳罗常数的值.下列叙述错误的是( )
| A. | 标准状况下,22.4 L CH4中含有分子的数目为NA | |
| B. | 标准状况下,2.24 L Cl2与足量铁反应,转移电子的数目为0.3NA | |
| C. | 常温常压下,46 g NO2和N2O4混合气体中含有的原子数为3NA | |
| D. | 标准状况下,2.24 LCO2与足量镁反应,转移电子的数目为0.4NA |
3.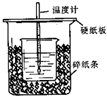 已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌器.
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等 (填“相等、不相等”),所求中和热相等(填“相等、不相等”),
(3)已知滇池中学高二一班某同学的实验记录如表,
请根据有用数据计算中和热(酸碱的密度均视为1g/ml,C=4.17J/g.℃)-56.8kJ/mol
(4)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大”、“偏小”、“无影响”).
 已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
已知稀的酸与稀的碱发生中和反应,生成1mol水所放出的热叫中和热,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌器.
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等 (填“相等、不相等”),所求中和热相等(填“相等、不相等”),
(3)已知滇池中学高二一班某同学的实验记录如表,
| 实验次数 | 酸的温度 | 碱的温度 | 反应最高温度 |
| 1 | 21.5℃ | 20.5℃ | 24.3℃ |
| 2 | 21.5℃ | 21.5℃ | 25.0℃ |
| 3 | 16.0℃ | 18.5℃ | 21.5℃ |
(4)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小;(填“偏大”、“偏小”、“无影响”).
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使pH试纸显深蓝色的溶液:Na+、K+、I-、NO${\;}_{3}^{-}$ | |
| B. | 0.1mol•L-1的Ca(ClO)2溶液:K+、Na+、I-、Cl- | |
| C. | 能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO${\;}_{3}^{-}$ | |
| D. | 加KSCN显红色的溶液:Na+、Mg2+、I-、SO${\;}_{4}^{2-}$ |
7.用铂作电极电解相同浓度的盐酸和硫酸,一段时间后,下列说法正确的是( )
| A. | 盐酸和硫酸的浓度都增大 | B. | 盐酸和硫酸的浓度都减大 | ||
| C. | 盐酸的浓度减小,硫酸的浓度增大 | D. | 盐酸的浓度增大,硫酸的浓度减小 |
7. 四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.
四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.
请回答下列问题:
(1)元素W的最高价氧化物对应的水化物的化学式为HClO4;
(2)这些元素的氢化物中,水溶液碱性最强的化合物是NH3.H2O或NH3(写化学式);
(3)X、Y、Z、W形成的简单阴离子半径大小顺序为S2->Cl->N3->O2-(用离子符号填空);证明W的非金属性比强Z的最简单方法是H2S+Cl2=S+2HCl(用化学方程式填空);
(4)Z的低价氧化物通入W的单质形成的水溶液中反应的化学方程式:SO2+Cl2+2H2O=H2SO4+2HCl;
(5)Z的低价氧化物能与Y的单质在一定体积的密闭容器反应,该反应属于可逆反应(填“可逆反应”或“非可逆反应”),反应速率与时间关系如图所示,t1到t2反应速率逐渐加快的原因是浓度变化不明显,反应放热,温度升高,反应速率加快,在t3(填“t1”“t2”或“t3”)时达到平衡;对该反应,下列说法正确的是AC.
A.Y的单质是氧化剂
B.混合气体的密度不再改变,可以判断反应达到平衡状态
C.Z的低价氧化物能使品红褪色
D.反应达到平衡状态时,反应停止
(6)将一定量的W单质通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaW、NaWO、NaWO3共存体系,则消耗的W单质的物质的量为0.15mol.
 四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.
四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.| X | Y | |
| Z | W |
(1)元素W的最高价氧化物对应的水化物的化学式为HClO4;
(2)这些元素的氢化物中,水溶液碱性最强的化合物是NH3.H2O或NH3(写化学式);
(3)X、Y、Z、W形成的简单阴离子半径大小顺序为S2->Cl->N3->O2-(用离子符号填空);证明W的非金属性比强Z的最简单方法是H2S+Cl2=S+2HCl(用化学方程式填空);
(4)Z的低价氧化物通入W的单质形成的水溶液中反应的化学方程式:SO2+Cl2+2H2O=H2SO4+2HCl;
(5)Z的低价氧化物能与Y的单质在一定体积的密闭容器反应,该反应属于可逆反应(填“可逆反应”或“非可逆反应”),反应速率与时间关系如图所示,t1到t2反应速率逐渐加快的原因是浓度变化不明显,反应放热,温度升高,反应速率加快,在t3(填“t1”“t2”或“t3”)时达到平衡;对该反应,下列说法正确的是AC.
A.Y的单质是氧化剂
B.混合气体的密度不再改变,可以判断反应达到平衡状态
C.Z的低价氧化物能使品红褪色
D.反应达到平衡状态时,反应停止
(6)将一定量的W单质通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaW、NaWO、NaWO3共存体系,则消耗的W单质的物质的量为0.15mol.
14.分子式为C5H10O3并能使新制Cu(OH)2悬浊液溶解,继续加热会出现砖红色沉淀的有机物有(不含立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
12.两种气态烃混合气体共1L,在空气中完全燃烧得到1.5L CO2和2L水蒸气(气体体积均在150℃条件下测定),关于此混合气体的判断合理的是( )
| A. | 一定含有甲烷 | B. | 一定含有乙烯 | ||
| C. | 可能是乙烷和甲烷的混合气体 | D. | 一定含有乙烯,不一定含有甲烷 |
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.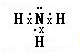 .
.