题目内容
7.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.图为N2(g)和O2(g)生成NO(g)过程中的能量变化,下列说法中正确的是( )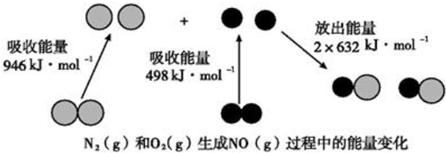
| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180kJ | |
| B. | 1mol N2(g)和1mol O2(g)具有的总能量小于2molNO(g)具有的总能量 | |
| C. | 该反应中反应物断开化学键所吸收的总能量小于生成物形成化学键所释放出的总能量 | |
| D. | 恒容密闭容器中,充入Ar气,该反应速率加快 |
分析 A、分析能量变化黑球代表氧原子,依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算判断;
B、依据A计算的焓变判断反应能量变化,结合反应前后能量守恒分析;
C.焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2+O2=2NO,△H=946KJ/mol+498KJ/mol-2×632KJ/mol=180KJ/mol,反应是吸热反应;
D.恒容密闭容器中,充入Ar气为惰气,容器中总压增大分压不变,反应速率不变,平衡不变.
解答 解:A、焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2+O2=2NO,△H=946KJ/mol+498KJ/mol-2×632KJ/mol=180KJ/mol,反应是吸热反应,故A错误;
B、依据A计算可知反应是吸热反应,依据能量守恒,1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故B正确;
C.该反应中反应物断开化学键所吸收的总能量大于生成物形成化学键所释放出的总能量,反应为吸热反应,故C错误;
D.恒容密闭容器中,充入Ar气为惰气,容器中总压增大分压不变,参加反应气体的浓度不变,则反应速率不变,故D错误;
故选B.
点评 本题考查了反应能量变化的计算和判断,反应的焓变计算方法和能量守恒是解题关键,题目难度中等.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
18.对外加电流的保护中,下列叙述正确的是( )
| A. | 被保护的金属与电源的正极相连 | |
| B. | 被保护的金属表面上不发生氧化反应,也不发生还原反应 | |
| C. | 在被保护的金属表面上发生氧化反应 | |
| D. | 被保护的金属与电源的负极相连 |
15.化学元素家族又添新成员,113号元素Uut和115号元素Uup.已知113号元素的一种核素为${\;}_{113}^{278}$Uut,下列说法中正确的是( )
| A. | 113号元素的相对原子质量为278 | |
| B. | 115号元素可显+5价 | |
| C. | ${\;}_{113}^{278}$Uut的中子数与电子数之差为165 | |
| D. | 两种元素均位于周期表第八周期 |
2.设NA伏加徳罗常数的值.下列叙述错误的是( )
| A. | 标准状况下,22.4 L CH4中含有分子的数目为NA | |
| B. | 标准状况下,2.24 L Cl2与足量铁反应,转移电子的数目为0.3NA | |
| C. | 常温常压下,46 g NO2和N2O4混合气体中含有的原子数为3NA | |
| D. | 标准状况下,2.24 LCO2与足量镁反应,转移电子的数目为0.4NA |
12.已知金刚石在一定条件下转化成石墨是放热的.据此,以下判断或说法错误的是( )
| A. | 放热反应在常温下一定都能发生 | |
| B. | 等质量的石墨与金刚石完全燃烧,金刚石放出的热量多 | |
| C. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| D. | 石墨比金刚石稳定 |
19.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气.有关此电池的推断正确的是( )
| A. | 放电过程中KOH的物质的量浓度不变 | |
| B. | 负极反应为14H2O+7O2+28e-=28OH- | |
| C. | 放电一段时间后,负极周围的pH升高 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
16.下列关于煤、石油和天然气及其相关产品的叙述错误的是( )
| A. | 液化天然气(LNG)和罐装液化石油气(LPG)主要成分都属于烃类 | |
| B. | 煤经过干馏可以得到焦炭和煤焦油等产品,分馏煤焦油可以获得多种芳香烃 | |
| C. | 石油裂化的主要目的是提高轻质液体燃料的产量和质量 | |
| D. | 石油的分馏、煤的液化、煤的气化属于物理变化 |
7. 四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.
四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.
请回答下列问题:
(1)元素W的最高价氧化物对应的水化物的化学式为HClO4;
(2)这些元素的氢化物中,水溶液碱性最强的化合物是NH3.H2O或NH3(写化学式);
(3)X、Y、Z、W形成的简单阴离子半径大小顺序为S2->Cl->N3->O2-(用离子符号填空);证明W的非金属性比强Z的最简单方法是H2S+Cl2=S+2HCl(用化学方程式填空);
(4)Z的低价氧化物通入W的单质形成的水溶液中反应的化学方程式:SO2+Cl2+2H2O=H2SO4+2HCl;
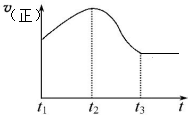
(5)Z的低价氧化物能与Y的单质在一定体积的密闭容器反应,该反应属于可逆反应(填“可逆反应”或“非可逆反应”),反应速率与时间关系如图所示,t1到t2反应速率逐渐加快的原因是浓度变化不明显,反应放热,温度升高,反应速率加快,在t3(填“t1”“t2”或“t3”)时达到平衡;对该反应,下列说法正确的是AC.
A.Y的单质是氧化剂
B.混合气体的密度不再改变,可以判断反应达到平衡状态
C.Z的低价氧化物能使品红褪色
D.反应达到平衡状态时,反应停止
(6)将一定量的W单质通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaW、NaWO、NaWO3共存体系,则消耗的W单质的物质的量为0.15mol.
 四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.
四种短周期元素在周期表中的相对位置如下所示,其中Y元素原子最外层电子数是其电子层数的3倍.| X | Y | |
| Z | W |
(1)元素W的最高价氧化物对应的水化物的化学式为HClO4;
(2)这些元素的氢化物中,水溶液碱性最强的化合物是NH3.H2O或NH3(写化学式);
(3)X、Y、Z、W形成的简单阴离子半径大小顺序为S2->Cl->N3->O2-(用离子符号填空);证明W的非金属性比强Z的最简单方法是H2S+Cl2=S+2HCl(用化学方程式填空);
(4)Z的低价氧化物通入W的单质形成的水溶液中反应的化学方程式:SO2+Cl2+2H2O=H2SO4+2HCl;
(5)Z的低价氧化物能与Y的单质在一定体积的密闭容器反应,该反应属于可逆反应(填“可逆反应”或“非可逆反应”),反应速率与时间关系如图所示,t1到t2反应速率逐渐加快的原因是浓度变化不明显,反应放热,温度升高,反应速率加快,在t3(填“t1”“t2”或“t3”)时达到平衡;对该反应,下列说法正确的是AC.
A.Y的单质是氧化剂
B.混合气体的密度不再改变,可以判断反应达到平衡状态
C.Z的低价氧化物能使品红褪色
D.反应达到平衡状态时,反应停止
(6)将一定量的W单质通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaW、NaWO、NaWO3共存体系,则消耗的W单质的物质的量为0.15mol.
