题目内容
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法不正确的是( )
| A、化合物BmAm分子中所有原子一定共平面 |
| B、一定条件下,元素C、D、E的最高价氧化物对应的水化物之间能发生反应 |
| C、工业上常用电解法制备元素C、D、E的单质 |
| D、化合物BAn与BEn具有相同类型的化学键 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素 B 的原子最外层电子数是其电子层数的2倍,电子层数只可能是2,最外层电子数为4,故B为C元素;元素C在同周期的主族元素中原子半径最大,处于IA族,原子序数大于碳,只能处于第三周期,故C为Na;由原子序数可知D、E均处于第三周期,元素D的合金是日常生活中常用的金属材料,则D为Al;元素A、E的单质在常温下呈气态,则E为Cl,A的原子序数小于碳,则A为H元素,据此解答.
解答:
解:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素 B 的原子最外层电子数是其电子层数的2倍,电子层数只可能是2,最外层电子数为4,故B为C元素;元素C在同周期的主族元素中原子半径最大,处于IA族,原子序数大于碳,只能处于第三周期,故C为Na;由原子序数可知D、E均处于第三周期,元素D的合金是日常生活中常用的金属材料,则D为Al;元素A、E的单质在常温下呈气态,则E为Cl,A的原子序数小于碳,则A为H元素,
A.化合物BmAm可以为C2H2,可以为苯乙烯等,苯乙烯中苯环与碳碳双键不一定处于同一平面,故A错误;
B.元素C、D、E的最高价氧化物对应的水化物分别为NaOH、氢氧化铝、高氯酸,氢氧化钠与高氯酸发生中和反应,氢氧化铝属于两性氢氧化物,能与氢氧化钠、高氯酸反应,故B正确;
C.工业上,电解熔融氯化钠生成Na,电解熔融氧化铝冶炼Al,电解饱和氯化钠溶液生成氯气,故C正确;
D.化合物CH4与CCl4都含有共价键,故D正确,
故选A.
A.化合物BmAm可以为C2H2,可以为苯乙烯等,苯乙烯中苯环与碳碳双键不一定处于同一平面,故A错误;
B.元素C、D、E的最高价氧化物对应的水化物分别为NaOH、氢氧化铝、高氯酸,氢氧化钠与高氯酸发生中和反应,氢氧化铝属于两性氢氧化物,能与氢氧化钠、高氯酸反应,故B正确;
C.工业上,电解熔融氯化钠生成Na,电解熔融氧化铝冶炼Al,电解饱和氯化钠溶液生成氯气,故C正确;
D.化合物CH4与CCl4都含有共价键,故D正确,
故选A.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,A选项为易错点,学生容易考虑乙炔,忽略苯乙烯等一类物质.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
下列说法正确的是( )
| A、ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| B、第三周期元素的离子半径从左到右逐渐减小 |
| C、同周期非金属氧化物对应的水化物的酸性从左到右依次增强 |
| D、ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |

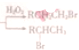 (R:烃基或氧原子,R′:烃基)
(R:烃基或氧原子,R′:烃基)
 写出以丙烯和
写出以丙烯和 为原料制备A物质的合成路线图(无机试剂任选),合成路线流程图如下:CH2=CH2
为原料制备A物质的合成路线图(无机试剂任选),合成路线流程图如下:CH2=CH2


 (-R1、R2表示氢原子或烃基)
(-R1、R2表示氢原子或烃基)