题目内容
3.某烃的含氧衍生物A能发生如下图所示的变化.已知A的蒸气密度是相同条件下H2的88倍,C的所有碳原子在同一平面上,J分子中所有碳原子在一条直线上,H遇FeCl3溶液显紫色.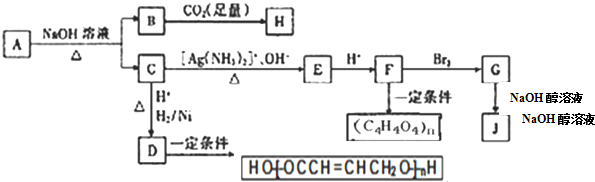
(1)A分子中含有的官能团有醛基、碳碳双键、酯基. C→E的反应方程式为OHC-CH=CH-COONa+2Ag(NH3)2OH$\stackrel{△}{→}$NH4OOC-CH=CH-COONa+2Ag↓+3NH3+H2O.
(2)写出由G生成J的反应方程式为HOOCCHBrCHBrCOOH+4NaOH$→_{△}^{醇}$NaOOC-C≡C-COONa+2NaBr+4H2O.
(3)由D生成 HO-[-OC CH=CHCH2 O-]-nH的反应类型为缩聚反应.由F到G的反应类型为加聚反应.
(4)A的同分异构体甚多,满足下列条件的A的有同分异构体有25种(不考虑立体异构),
①含苯环,②含羧基,③含醛基,④含碳碳双键.
其中核磁共振氢谱峰面积比是1:2:2:2:1的是
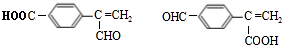 .
.
分析 A在氢氧化钠水溶液、加热条件下得到B、C,A中含有酯基,而B与足量二氧化碳反应得到H,H遇FeCl3溶液显紫色,则H属于酚类,C能与银氨溶液反应,则C中应含有-CHO,C酸化后再与氢气发生加成反应得到D,则D中含有-COOH、-OH,D发生缩聚反应得到(C4H6O2)n,结合J中所有碳原子在一条直线上,可推知D为HOCH2CH2CH2COOH,F能与溴发生反应得到G,G发生消去反应生成J,J分子中所有碳原子在一条直线上,则J存在-C≡C-三键,结合C的所有碳原子在同一平面上,可知C、E、F中含有C=C双键,综上分析,可推知C为OHC-CH=CH-COONa,顺推可得E为NH4OOC-CH=CH-COONa,F为HOOC-CH=CH-COOH,G为HOOCCHBrCHBrCOOH,J为HOOC-C≡C-COOH.烃的含氧衍生物A的蒸气密度是相同条件下H2的88倍,则其相对分子质量=88×2=176,结合C的结构可知H的相对分子质量=176+18-100=94,而H为酚类,可知H为 ,B为苯酚钠,故A为
,B为苯酚钠,故A为 ,据此解答.
,据此解答.
解答 解:A在氢氧化钠水溶液、加热条件下得到B、C,A中含有酯基,而B与足量二氧化碳反应得到H,H遇FeCl3溶液显紫色,则H属于酚类,C能与银氨溶液反应,则C中应含有-CHO,C酸化后再与氢气发生加成反应得到D,则D中含有-COOH、-OH,D发生缩聚反应得到(C4H6O2)n,结合J中所有碳原子在一条直线上,可推知D为HOCH2CH2CH2COOH,F能与溴发生反应得到G,G发生消去反应生成J,J分子中所有碳原子在一条直线上,则J存在-C≡C-三键,结合C的所有碳原子在同一平面上,可知C、E、F中含有C=C双键,综上分析,可推知C为OHC-CH=CH-COONa,顺推可得E为NH4OOC-CH=CH-COONa,F为HOOC-CH=CH-COOH,G为HOOCCHBrCHBrCOOH,J为HOOC-C≡C-COOH.烃的含氧衍生物A的蒸气密度是相同条件下H2的88倍,则其相对分子质量=88×2=176,结合C的结构可知H的相对分子质量=176+18-100=94,而H为酚类,可知H为 ,B为苯酚钠,故A为
,B为苯酚钠,故A为 .
.
(1)A为 ,分子中含有的官能团有:醛基、碳碳双键、酯基;
,分子中含有的官能团有:醛基、碳碳双键、酯基;
C→E的反应方程式为:OHC-CH=CH-COONa+2Ag(NH3)2OH$\stackrel{△}{→}$NH4OOC-CH=CH-COONa+2Ag↓+3NH3+H2O,
故答案为:醛基、碳碳双键、酯基;OHC-CH=CH-COONa+2Ag(NH3)2OH$\stackrel{△}{→}$NH4OOC-CH=CH-COONa+2Ag↓+3NH3+H2O;
(2)G生成J的反应方程式为:HOOCCHBrCHBrCOOH+4NaOH$→_{△}^{醇}$NaOOC-C≡C-COONa+2NaBr+4H2O,
故答案为:HOOCCHBrCHBrCOOH+4NaOH$→_{△}^{醇}$NaOOC-C≡C-COONa+2NaBr+4H2O;
(3)由D生成 HO-[-OC CH=CHCH2 O-]-nH的反应类型为缩聚反应,由F到G的反应类型为加聚反应,
故答案为:缩聚反应;加聚反应;
(4)A为 ,其同分异构体满足下列条件(不考虑立体异构):①含苯环; ②含羧基;③含醛基; ④含碳碳双键,
,其同分异构体满足下列条件(不考虑立体异构):①含苯环; ②含羧基;③含醛基; ④含碳碳双键,
含有1个侧链,可以为HOOC-CH=C(CHO)-,HCOOC(CHO)=CH-,OCH-CH=C(COOH)-,有3种,
含有2个侧链,可以为-CHO、-CH=CHCOOH,可以为-COOH、-CH=CH-CHO,可以为-CHO、-C(COOH)=CH2,可以为-COOH、-C(CHO)=CH2,各有邻、间、对3种,
含有3个侧链,为-CHO、CH2=CH-、-COOH,若-CHO、CH2=CH-处于邻位,-COOH有4种位置,若-CHO、CH2=CH-处于间位,-COOH有4种位置,若-CHO、CH2=CH-处于对位,-COOH有2种位置,
故符合条件的同分异构体有:3+3×4+4+4+2=25种,
其中核磁共振氢谱峰面积比是1:2:2:2:1的是: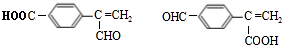
故答案为:25;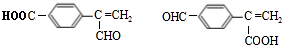 .
.
点评 本题考查有机物推断,根据题目信息利用正、逆推法相结合进行推断,综合考查学生分析推理能力、知识迁移运用,(4)中同分异构体数目判断为易错点,题目难度较大.

 名校课堂系列答案
名校课堂系列答案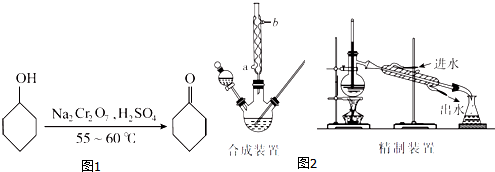
环己醇、环己酮和水的部分物理性质见下表(*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点):
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 98 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 18 | 100.0 | 0.9982 |
A.一次性加入
B.缓慢加入
C.无所谓,怎样加入都可以
(2)若酸性Na2Cr2O7溶液的体积为35 mL,则应选取100mL(填“100 mL”或“250 mL”)的三颈瓶.
(3)反应完成后,加入适量水,蒸馏,收集95~100℃的馏分(设为A),其主要成分是环己酮和水的混合物.
(4)合成装置中冷凝管的作用是冷凝回流,冷凝水从冷凝管的a(填“a”或“b”)口进入.
(5)在馏分A中加入氯化钠固体至饱和,振荡、静置、分液,得有机层(设为B).加入氯化钠固体的作用是降低有机物在水层得溶解度,有利于液体分层.
(6)在有机层B中加入无水硫酸镁固体,除去其中的少量水分.过滤,将滤液置于精制装置中蒸馏,收集B(填代号)的馏分,得到纯净的环己酮.
A.100.0~102.0℃
B.154.0~156.0℃
C.160.0~162.0℃
(7)精制装置中的错误是温度计的水银球未与蒸馏烧瓶支管口平齐(或冷凝水进、出口方向颠倒).(任写一点)
(8)若最终得到环己酮的质量为3.43 g,则环己酮的产率是70%.
| A. | 分子晶体中一定含有分子间作用力,但不一定含有共价键 | |
| B. | 离子晶体中一定含有离子键,但不一定含有共价键 | |
| C. | 原子晶体中一定含有共价键,硬度大,熔沸点高 | |
| D. | 原子晶体都不导电 |
| A. | 0.2mol | B. | 0.25 mol | C. | 0.35 mol | D. | 0.45 mol |
| A. | ②④⑤ | B. | ①②③ | C. | ①③⑤ | D. | ②③④ |
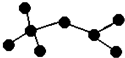 如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:
如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:(1)用系统命名法命名2,2,4-三甲基戊烷.
(2)M的一氯代物有4种.
(3)含有一个甲基和一个乙基的M的同分异构体有2种.
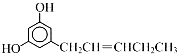
| A. | 既有σ键又有π键 | |
| B. | O-H键的极性强于C-H键的极性 | |
| C. | 是极性分子 | |
| D. | 该物质的分子之间不能形成氢键,但它可以与水分子形成氢键 |
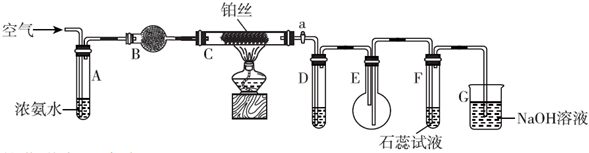
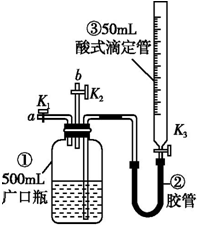 某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.
某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.