题目内容
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.(1)阴影部分元素N在元素周期表中的位置为
根据元素周期律,预测:酸性强弱 H3AsO4
(2)元素S的最高正价和最低负价的代数和为
(3)O原子与氢原子可形成10电子阴离子,写出该阴离子的电子式
(4)Cl2、Br2、I2均可从中海洋提取,Br2的提取是采用向酸化的浓海水中通入Cl2置换出Br-的方法而获得,有关的离子方程式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)阴影部分为周期表第ⅤA族;元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
(2)元素S的最高正价和最低负价分别为+6价、-2价,元素的非金属性越小,单质的氧化性越弱,与H2反应限度越小;
(3)O原子与氢原子可形成10电子阴离子,为OH-;
(4)氯气具有强氧化性,可与Br-反应生成Br2,Br2可与SO2发生氧化还原反应.
(2)元素S的最高正价和最低负价分别为+6价、-2价,元素的非金属性越小,单质的氧化性越弱,与H2反应限度越小;
(3)O原子与氢原子可形成10电子阴离子,为OH-;
(4)氯气具有强氧化性,可与Br-反应生成Br2,Br2可与SO2发生氧化还原反应.
解答:
解:(1)阴影部分为周期表第ⅤA族,N位于第二周期,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性强弱 H3AsO4<H3PO4,
故答案为:第二周期第ⅤA族;<;
(2)元素S的最高正价和最低负价分别为+6价、-2价,则元素S的最高正价和最低负价的代数和为4,元素的非金属性越小,单质的氧化性越弱,与H2反应限度越小,故答案为:4;更小;
(3)O原子与氢原子可形成10电子阴离子,为OH-,电子式为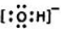 ,故答案为:
,故答案为: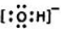 ;
;
(4)氯气具有氧化性,能氧化溴离子生成单质溴,反应的方程式为Cl2+2Br-=Br2+2Cl-,二氧化硫吸收溴单质发生反应,SO2+Br2+2H2O=H2SO4+2HCI,离子方程式为SO2+Br2+2H2O═4H++2Br-+SO42-,则溶液中存在的主要离子是H+、Br-、SO42-,故答案为:Cl2+2Br-=Br2+2Cl-;H+、Br-、SO42-.
故答案为:第二周期第ⅤA族;<;
(2)元素S的最高正价和最低负价分别为+6价、-2价,则元素S的最高正价和最低负价的代数和为4,元素的非金属性越小,单质的氧化性越弱,与H2反应限度越小,故答案为:4;更小;
(3)O原子与氢原子可形成10电子阴离子,为OH-,电子式为
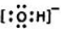 ,故答案为:
,故答案为: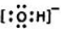 ;
;(4)氯气具有氧化性,能氧化溴离子生成单质溴,反应的方程式为Cl2+2Br-=Br2+2Cl-,二氧化硫吸收溴单质发生反应,SO2+Br2+2H2O=H2SO4+2HCI,离子方程式为SO2+Br2+2H2O═4H++2Br-+SO42-,则溶液中存在的主要离子是H+、Br-、SO42-,故答案为:Cl2+2Br-=Br2+2Cl-;H+、Br-、SO42-.
点评:本题考查较为综合,涉及元素周期表、周期律、海水的淡化,氧化还原反应等知识,侧重于考查学生综合运用化学知识的能力,题目难度不大,注意相关基础知识的积累.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
下列变化属于化学变化的是( )
①海水中提取溴 ②石油的减压分馏 ③煤的气化 ④海水中提取食盐
⑤重油的催化裂化 ⑥苯中加溴水分层 ⑦煤的干馏 ⑧煤与氢气作用液化.
①海水中提取溴 ②石油的减压分馏 ③煤的气化 ④海水中提取食盐
⑤重油的催化裂化 ⑥苯中加溴水分层 ⑦煤的干馏 ⑧煤与氢气作用液化.
| A、②③⑥⑦⑧ |
| B、②④⑤⑥⑦ |
| C、①③②④⑦ |
| D、①③⑤⑦⑧ |
从氧化还原角度分析,下列反应中水的作用相同的是( )
①铁和水蒸气反应 ②过氧化钠和水反应
③氯气和水反应 ④二氧化氮和水反应3NO2+H2O=2HNO3+NO.
①铁和水蒸气反应 ②过氧化钠和水反应
③氯气和水反应 ④二氧化氮和水反应3NO2+H2O=2HNO3+NO.
| A、①②③ | B、①②④ |
| C、②③④ | D、①③④ |
 Ⅰ.下列有关操作正确的是
Ⅰ.下列有关操作正确的是
 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子. 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.