题目内容
可逆反应A(g)+2B(g)?2C(g)△H=-QkJ?mol-1 (Q>0)在一个密闭容器中进行,并在一定条件下达到平衡.若改变条件,将相应的变化结果(“增大”、“减小”或“不变”)填入下列空格.
(1)保持温度和压强不变,加入不参与反应的稀有气体,A的转化率 .v正 ,v逆
(2)保持温度和体积不变,加入不参与反应的稀有气体,A的转化率 .v正 ,v逆
(3)若温度和体积不变,反应从A、B开始至平衡,在这个变化过程中,容器内气体的密度 ,压强 .
(1)保持温度和压强不变,加入不参与反应的稀有气体,A的转化率
(2)保持温度和体积不变,加入不参与反应的稀有气体,A的转化率
(3)若温度和体积不变,反应从A、B开始至平衡,在这个变化过程中,容器内气体的密度
考点:化学平衡的影响因素
专题:化学平衡专题
分析:(1)恒温恒压容器中加入不参与反应的稀有气体,体积增大,压强减小,反应速率减小,平衡逆向进行;
(2)保持温度和体积不变,加入不参与反应的稀有气体,反应体系中各物质浓度不变,反应速率不变,不改变化学平衡;
(3)若温度和体积不变,反应从A、B开始至平衡,气体体积减小,压强减小,气体质量和容器体积不变,密度不变.
(2)保持温度和体积不变,加入不参与反应的稀有气体,反应体系中各物质浓度不变,反应速率不变,不改变化学平衡;
(3)若温度和体积不变,反应从A、B开始至平衡,气体体积减小,压强减小,气体质量和容器体积不变,密度不变.
解答:
解:(1)恒温恒压容器中加入不参与反应的稀有气体,体积增大,压强减小,反应速率减小,平衡逆向进行,A的转化率减小,正逆反应速率减小;
故答案为:减小;减小;减小;
(2)保持温度和体积不变,加入不参与反应的稀有气体,反应体系中各物质浓度不变,反应速率不变,不改变化学平衡,A的转化率不变,正逆反应速率不变;
故答案为:不变;不变;不变;
(3)若温度和体积不变,反应从A、B开始至平衡,气体体积减小,压强减小,气体质量和容器体积不变,密度不变;
故答案为:不变;减小.
故答案为:减小;减小;减小;
(2)保持温度和体积不变,加入不参与反应的稀有气体,反应体系中各物质浓度不变,反应速率不变,不改变化学平衡,A的转化率不变,正逆反应速率不变;
故答案为:不变;不变;不变;
(3)若温度和体积不变,反应从A、B开始至平衡,气体体积减小,压强减小,气体质量和容器体积不变,密度不变;
故答案为:不变;减小.
点评:本题考查了化学平衡移动原理的分析判断,注意反应特征和移动原理的分析应用,掌握基础是关键,题目较简单.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案
相关题目
下列有关说法正确的是( )
A、由-CH3、 、-OH、-COOH四种原子团两两组合形成的有机物中,属于弱电解质的有4种 、-OH、-COOH四种原子团两两组合形成的有机物中,属于弱电解质的有4种 | ||
B、向含有 溶液中分别加入少量NaOH固体、少量浓盐酸或少量酸性高锰酸钾溶液,都能使其浓度下降 溶液中分别加入少量NaOH固体、少量浓盐酸或少量酸性高锰酸钾溶液,都能使其浓度下降 | ||
C、有机物X、Y、M的转化关系为淀粉→X→Y
| ||
D、高分子化合物 ,其链节为对苯二甲酸和乙二醇 ,其链节为对苯二甲酸和乙二醇 |
下列有机反应类型判断错误的是( )
| A、CH4+Cl2→CH3Cl+HCl 取代反应 | ||
B、CH2=CH2+HCl
| ||
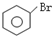
C、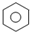 +Br2 +Br2
 +HBr 取代反应 +HBr 取代反应 | ||
D、2CH3CH2OH+O2
|
化学键的键能是指气态原子间形成1mol 化学键时释放的能量.如H(g)+Cl(g)═H-Cl(g)△H=-431kJ?mol-1,即H-Cl键的键能为431kJ?mol-1,也可以理解为破坏1mol H-Cl键需要吸收431kJ的能量.已知2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,蒸发1mol H2O(l)需要吸收的能量为44kJ,其他相关数据如下表:则表中a为( )
| H-H | O═O | H-O | |
| 键能(kJ/mol) | 436.4 | a | 462.8 |
| A、185.2 |
| B、224.0 |
| C、518.8 |
| D、494.8 |
既能与盐酸反应,又能与氢氧化钠反应的有机物是( )
| A、CH3COOH |
| B、丙氨酸 |
| C、Al(OH)3 |
| D、NaHCO3 |

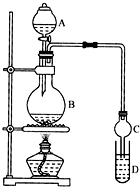 乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
乙酸乙酯是一种用途广泛的精细化工产品.某课外小组设计实验室制取并提纯乙酸乙酯的方案如下: