题目内容
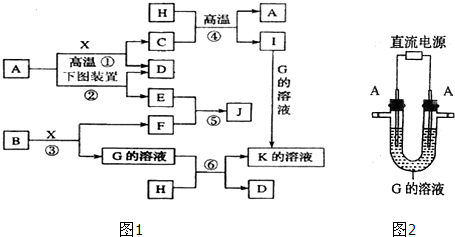
离子化合物A由X、Y两种元素组成.在空气中充分灼烧得到含X元素的8g红棕色固体B,并产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,过滤、洗涤、干燥得46.6g固体.
(1)写出A的电子式 ;
(2)写出气体C通入H2O2的离子方程式 ;
(3)将A溶于D的稀溶液中生成E,并产生一种单质和一种气体,写出该反应的化学方程式 ;
(4)将化合物E隔绝空气充分灼烧,使其分解,生成等物质的量的B、C和另一种化合物,则另一种化合物的化学式是 ;有同学认为该分解反应得到的固体产物中除B外,还可能会有含X元素的低价态物质,请判断该同学的观点是否合理 .理由是 ;
(5)设计实验判断E完全分解后的固体产物中X元素的价态 .
(1)写出A的电子式
(2)写出气体C通入H2O2的离子方程式
(3)将A溶于D的稀溶液中生成E,并产生一种单质和一种气体,写出该反应的化学方程式
(4)将化合物E隔绝空气充分灼烧,使其分解,生成等物质的量的B、C和另一种化合物,则另一种化合物的化学式是
(5)设计实验判断E完全分解后的固体产物中X元素的价态
考点:无机物的推断
专题:推断题
分析:离子化合物A由X、Y两种元素组成.在空气中充分灼烧得到含X元素的8g红棕色固体B,则B为Fe2O3,X为Fe,产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,得到46.6g固体,该固体为BaSO4,故C为SO2,D为H2SO4,则Y为S,氧化铁的物质的量=
=0.05mol,硫酸钡的物质的量=
=0.2mol,根据原子守恒化合物A中Fe、S原子数目之比=0.05mol×2:0.2mol=1:2,故A为FeS2,据此解答.
| 8g |
| 160g/mol |
| 46.6g |
| 233g/mol |
解答:
解:离子化合物A由X、Y两种元素组成.在空气中充分灼烧得到含X元素的8g红棕色固体B,则B为Fe2O3,X为Fe,产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,得到46.6g固体,该固体为BaSO4,故C为SO2,D为H2SO4,则Y为S,氧化铁的物质的量=
=0.05mol,硫酸钡的物质的量=
=0.2mol,根据原子守恒化合物A中Fe、S原子数目之比=0.05mol×2:0.2mol=1:2,故A为FeS2,
(1)由上述分析可知,离子化合物A为FeS2,电子式为: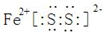 ,
,
故答案为: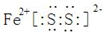 ;
;
(2)气体SO2通入H2O2中被氧化生成硫酸,反应离子方程式为:SO2+H2O2=2H++SO42-,
故答案为:SO2+H2O2=2H++SO42-;
(3)将FeS2溶于H2SO4的稀溶液中生成E,并产生一种单质和一种气体,应生成硫酸亚铁、硫化氢、硫,该反应的化学方程式为:FeS2+H2SO4=H2S↑+S↓+FeSO4,
故答案为:FeS2+H2SO4=H2S↑+S↓+FeSO4;
(4)将化合物FeSO4隔绝空气充分灼烧,使其分解,生成等物质的量的Fe2O3、SO2和另一种化合物,根据原子守恒,则另一种化合物的化学式是SO3;有同学认为该分解反应得到的固体产物中除Fe2O3外,还可能会有含Fe元素的低价态物质,该同学的观点合理,因为分解反应可能部分发生非氧化还原反应,
故答案为:SO3;合理,分解反应可能部分发生非氧化还原反应;
(5)判断FeSO4完全分解后的固体产物中Fe元素的价态,实验方案为:取少量固体加稀硫酸溶解,分成两份,向第一份加硫氰化钾,向第二份中加酸性高锰酸钾溶液,若第一份中出现血红色,第二份中不褪色则证明只含有Fe2O3,若反之则证明只含有FeO,若第一份出现血红色,第二份褪色,则证明两者都有,
故答案为:取少量固体加稀硫酸溶解,分成两份,向第一份加硫氰化钾,向第二份中加酸性高锰酸钾溶液,若第一份中出现血红色,第二份中不褪色则证明只含有Fe2O3,若反之则证明只含有FeO,若第一份出现血红色,第二份褪色,则证明两者都有.
| 8g |
| 160g/mol |
| 46.6g |
| 233g/mol |
(1)由上述分析可知,离子化合物A为FeS2,电子式为:
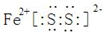 ,
,故答案为:
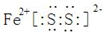 ;
;(2)气体SO2通入H2O2中被氧化生成硫酸,反应离子方程式为:SO2+H2O2=2H++SO42-,
故答案为:SO2+H2O2=2H++SO42-;
(3)将FeS2溶于H2SO4的稀溶液中生成E,并产生一种单质和一种气体,应生成硫酸亚铁、硫化氢、硫,该反应的化学方程式为:FeS2+H2SO4=H2S↑+S↓+FeSO4,
故答案为:FeS2+H2SO4=H2S↑+S↓+FeSO4;
(4)将化合物FeSO4隔绝空气充分灼烧,使其分解,生成等物质的量的Fe2O3、SO2和另一种化合物,根据原子守恒,则另一种化合物的化学式是SO3;有同学认为该分解反应得到的固体产物中除Fe2O3外,还可能会有含Fe元素的低价态物质,该同学的观点合理,因为分解反应可能部分发生非氧化还原反应,
故答案为:SO3;合理,分解反应可能部分发生非氧化还原反应;
(5)判断FeSO4完全分解后的固体产物中Fe元素的价态,实验方案为:取少量固体加稀硫酸溶解,分成两份,向第一份加硫氰化钾,向第二份中加酸性高锰酸钾溶液,若第一份中出现血红色,第二份中不褪色则证明只含有Fe2O3,若反之则证明只含有FeO,若第一份出现血红色,第二份褪色,则证明两者都有,
故答案为:取少量固体加稀硫酸溶解,分成两份,向第一份加硫氰化钾,向第二份中加酸性高锰酸钾溶液,若第一份中出现血红色,第二份中不褪色则证明只含有Fe2O3,若反之则证明只含有FeO,若第一份出现血红色,第二份褪色,则证明两者都有.
点评:本题考查无机物推断,属于计算型推断,侧重考查学生综合能力,难度较大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
下列实验装置或操作与粒子的大小无直接关系的是( )
A、 过滤 |
B、 渗析 |
C、 萃取 |
D、 丁达尔效应 |
某固体酸燃料电池以NaHSO4固体为电解质传递H+其基本结构见如图所示,电池总反应表示为:2H2+O2═2H2O下列有关说法正确的是( )


| A、电子通过外电路从b极流向a极 |
| B、H+由a极通过固体酸电解质传递到b极 |
| C、b极上的电极反应式为:O2+2H2O+4e-═4OH- |
| D、每转移0.1mol电子,消耗1.12L的H2 |
 如图所示为高温超导领域里的一种化合物--钙钛矿晶体结构,该结构是具有代表性的最小重复单位.
如图所示为高温超导领域里的一种化合物--钙钛矿晶体结构,该结构是具有代表性的最小重复单位. A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出).
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出).