题目内容
(1)在铜锌原电池中,以硫酸为电解质,锌为 极,电极反应式为 ,铜为 极,发生 反应,当导线通过电子3.01×1023个,则锌片质量减少 g,铜片析出氢气 L(标准状况).
(2)某原电池的总反应式为:2Fe3++Fe=3Fe2+,请你设计一个能实现该反应的原电池,试在下面画出草图.

(3)将等物质的量氢气和碘蒸气充入密闭容器中进行如下反应:H2+I2≒2HI,反应进行2min时测得HI的反应速率为0.1mol/L.min,碘蒸气的浓度为0.4mol/L,则氢气的反应速率为 mol/L.min,碘蒸气的起始浓度为 mol/L.
(2)某原电池的总反应式为:2Fe3++Fe=3Fe2+,请你设计一个能实现该反应的原电池,试在下面画出草图.

(3)将等物质的量氢气和碘蒸气充入密闭容器中进行如下反应:H2+I2≒2HI,反应进行2min时测得HI的反应速率为0.1mol/L.min,碘蒸气的浓度为0.4mol/L,则氢气的反应速率为
考点:设计原电池,原电池和电解池的工作原理
专题:电化学专题
分析:(1)Cu、Zn、稀硫酸构成的原电池中,Zn易失电子作负极、Cu作正极,负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,根据锌、氢气和转移电子之间的关系式计算;
(2)根据反应Fe+2Fe3+=3Fe2+可知Fe应为负极,被氧化,正极可为C、Cu等,电解质溶液含有Fe3+;
(3)同一可逆反应中同一时间段内,各物质的反应速率之比等于其计量数之比,从而计算氢气、碘的反应速率,根据△C=vt计算参加反应的碘的物质的量浓度,碘蒸气的起始浓度=2min末碘蒸气浓度+参加反应的碘蒸气浓度.
(2)根据反应Fe+2Fe3+=3Fe2+可知Fe应为负极,被氧化,正极可为C、Cu等,电解质溶液含有Fe3+;
(3)同一可逆反应中同一时间段内,各物质的反应速率之比等于其计量数之比,从而计算氢气、碘的反应速率,根据△C=vt计算参加反应的碘的物质的量浓度,碘蒸气的起始浓度=2min末碘蒸气浓度+参加反应的碘蒸气浓度.
解答:
解:(1)Cu、Zn、稀硫酸构成的原电池中,Zn易失电子作负极、Cu作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,负极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,根据锌和转移电子的关系式得,溶解锌的质量=
×1×65g/mol=16.25g,根据氢气和转移电子之间的关系式得,析出氢气体积=
×1×22.4L/mol=5.6L,
故答案为:负;Zn-2e-=Zn2+;还原;16.25;5.6;
(2)根据反应可知Fe应为负极,被氧化,正极可为C、Cu等,电解质溶液含有Fe3+,可为氯化铁或硫酸铁等,装置图为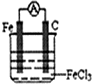 ,
,
故答案为: ;
;
(3)同一可逆反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(H2)=v(I2)=
v(HI)=
×0.1mol/L.min=0.05mol/L.min,参加反应的碘蒸气浓度△C=vt=0.05mol/L.min×2min=0.1mol/L,碘蒸气的起始浓度=2min末碘蒸气浓度+参加反应的碘蒸气浓度=0.1mol/L+0.4mol/L=0.5mol/L,
故答案为:0.05;0.5.
| ||
| 2 |
| ||
| 2 |
故答案为:负;Zn-2e-=Zn2+;还原;16.25;5.6;
(2)根据反应可知Fe应为负极,被氧化,正极可为C、Cu等,电解质溶液含有Fe3+,可为氯化铁或硫酸铁等,装置图为
 ,
,故答案为:
 ;
;(3)同一可逆反应中同一时间段内,各物质的反应速率之比等于其计量数之比,所以v(H2)=v(I2)=
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:0.05;0.5.
点评:本题考查原电池设计、化学反应速率等知识点,明确原电池中元素化合价升降与正负极反应是解本题关键,知道设计原电池时正负极、电解质溶液的确定,同时考查学生分析问题、解决问题能力,题目难度不大.

练习册系列答案
相关题目
用氯气漂白过的石蜡,(一种用石油分馏得到的固体烷烃),燃烧时会产生含氯元素的气体,这是由于石蜡在漂白时与氯气发生了( )
| A、物理溶解 | B、加成反应 |
| C、取代反应 | D、消去反应 |
下列实验装置或操作与粒子的大小无直接关系的是( )
A、 过滤 |
B、 渗析 |
C、 萃取 |
D、 丁达尔效应 |
 (1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
(1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示. 柠檬酸铁可用作食品铁质强化剂、营养增补剂,用于饼干、钙质奶粉等,它可以由柠檬酸(熔点为153°C)与氢氧化铁制得.其结构如图.
柠檬酸铁可用作食品铁质强化剂、营养增补剂,用于饼干、钙质奶粉等,它可以由柠檬酸(熔点为153°C)与氢氧化铁制得.其结构如图. 如图所示为高温超导领域里的一种化合物--钙钛矿晶体结构,该结构是具有代表性的最小重复单位.
如图所示为高温超导领域里的一种化合物--钙钛矿晶体结构,该结构是具有代表性的最小重复单位. A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出).
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件及部分产物均未列出).