题目内容
6.用如图所示装置证明浓硫酸的强氧化性,并检验产物的性质.请回答: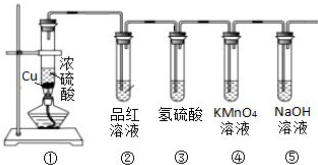
(1)装置①中反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)装置②中的现象是品红褪色.
(3)装置③中的现象可证明SO2有氧化性.
(4)装置④中反应的离子方程式5SO2+2MnO4-+2H2O═4H++Mn2++5SO42-.
(5)装置⑤的作用是吸收尾气.
分析 装置①金属铜和浓硫酸加热可以得到硫酸铜、二氧化硫和水,装置②是检验二氧化硫的装置,二氧化硫能使品红褪色,具有氧化性,能和还原性的物质反应,具有还原性,能和氧化剂高锰酸钾之间反应,尾气有毒,需要用氢氧化钠来处理.
(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(2)二氧化硫有漂白性,能使品红褪色;
(3)二氧化硫与硫化氢反应生成淡黄色的硫单质,根据化合价变化判断二氧化硫表现的性质;
(4)二氧化硫具有还原性,高锰酸钾具有氧化性,二者能够发生反应,据此写出反应的离子方程式;
(5)二氧化硫有毒,不能直接排放.
解答 解:装置①金属铜和浓硫酸加热可以得到硫酸铜、二氧化硫和水,装置②是检验二氧化硫的装置,二氧化硫能使品红褪色,具有氧化性,能和还原性的物质反应,具有还原性,能和氧化剂高锰酸钾之间反应,尾气有毒,需要用氢氧化钠来处理.
(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫有漂白性,能使品红褪色,
故答案为:品红褪色;
(3)装置③中盛放硫化氢,硫化氢能够与二氧化硫发生氧化还原反应生成淡黄色的硫单质,二氧化硫在反应中化合价降低,表现了氧化性,
故答案为:氧化;
(4)二氧化硫具有还原性,高锰酸钾具有氧化性,二者能够发生反应:5SO2+2MnO4-+2H2O═4H++Mn2++5SO42-,所以装置④中高锰酸钾褪色,
故答案为:5SO2+2MnO4-+2H2O═4H++Mn2++5SO42-;
(5)二氧化硫是一种有毒气体,多余的二氧化硫不能直接排放,避免污染空气;二氧化硫能够与氢氧化钠溶液反应:SO2+2NaOH═Na2SO3+H2O,可以用氢氧化钠溶液吸收多余的二氧化硫,
故答案为:吸收尾气.
点评 本题考查了浓硫酸的性质,题目难度中等,注意掌握浓硫酸的性质二氧化硫的性质及检验方法,试题知识点较多、充分考查了学生的分析、理解能力及化学实验能力.

(1)SO2的大量排放会引起严重的环境问题是酸雨,潮湿条件下,写出大气中SO2转化为HSO3-的方程式SO2+H2O?H2SO3;H2SO3?H++HSO3-.
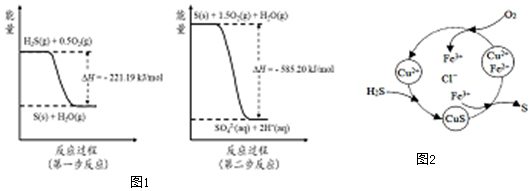
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图1如下:
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39kJ•mol-1.
(3)SO2是工业制硫酸的原料气体之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)?2SO3(g),过程中测定的部分数据见表:
| 时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.050 |
| 4 | 0.050 | 0.025 |
| 5 | 0.040 | |
| 8 | 0.020 |
②此温度下该反应的化学平衡常数K=225(mol/L),
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),重新达到平衡时混合气体中SO2的百分含量将减小(填“减小”,“增大”或“不变”).(4)将H2S 和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示:
①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌.欲使生成的硫单质中不含CuS,可采取的措施有通入足量的空气.
②一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较完全;相反,如果一个反应的平衡常数小于10-5,则认为这个反应很难进行.已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10-36;H2S:K a1=1.3×10-7,K a2=7.1×10-15,
通过计算说明反应CuS(s)+2H+ (aq)=Cu2+(aq)+H2S(aq)进行的程度反应很难进行.
| A. | 在镀件上电镀锌,用锌作阳极 | |
| B. | 电解法精炼粗铜,用纯铜作阴极 | |
| C. | 电解饱和食盐水制氯气,用涂镍碳钢网作阴极 | |
| D. | 电解熔融的氧化铝制取金属铝,用铁作阳极 |
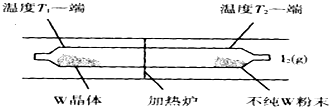
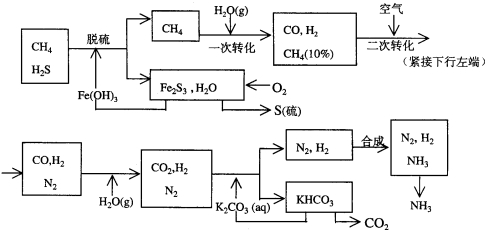
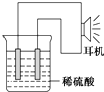 乙同学利用生活中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白:
乙同学利用生活中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白: