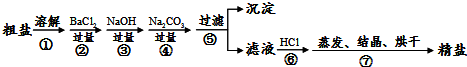
题目内容
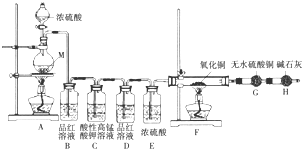
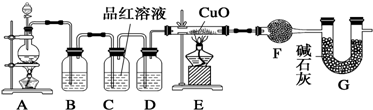
16.某同学利用如图装置可探究浓硫酸与木炭粉在加热条件下反应产生的三种气体产物,请填写下列空白:
(1)写出木炭粉与浓硫酸反应的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2S02↑+C02↑+2H2O.
(2)无水硫酸铜的作用是检验水的存在,②中3个洗气瓶的作用依次为检验有无S02生成、除去生成的S02气体、检验S02是否除尽.
分析 (1)木炭粉与浓硫酸反应生成SO2和CO2、水,据此写出反应的化学方程式;
(2)无水硫酸铜用于检验水的存在情况;A品红溶液用于检验二氧化硫气体;检验二氧化碳前必须确保混合气体中不含二氧化硫,所以B中酸性高锰酸钾溶液用于除去二氧化硫,C中品红溶液用于检验二氧化硫是否已经除尽.
解答 解:(1)木炭粉与浓硫酸反应生成SO2和CO2,反应的方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2S02↑+C02↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2S02↑+C02↑+2H2O;
(2)先用无水硫酸铜检验水的存在情况;SO2能使品红溶液褪色以及酸性高锰酸钾溶液褪色,②中A瓶品红的作用是检验有无S02生成,B瓶酸性高锰酸钾的作用除去生成的S02气体,C瓶品红溶液的作用是检验S02是否除尽,从而避免的二氧化硫对二氧化碳的检验的干扰,
故答案为:检验水的存在;检验有无S02生成;除去生成的S02气体;检验S02是否除尽.
点评 本题考查了浓硫酸的性质,题目难度不大,明确浓硫酸的性质为解答关键,注意掌握检验水、二氧化碳、二氧化硫的先后顺序,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.各取1mol的下列物质与溴水充分反应,消耗Br2的物质的量按①、②、③的顺序排列正确的是( )


| A. | 2 mol、2 mol、6 mol | B. | 5 mol、2 mol、6 mol | ||
| C. | 4 mol、2 mol、5 mol | D. | 3 mol、2 mol、6 mol |
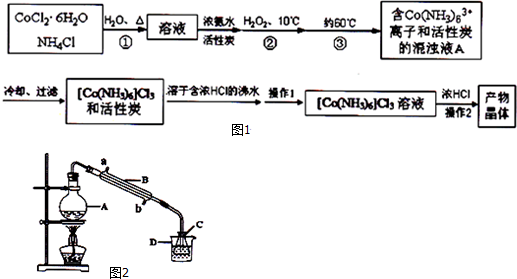
5.三氯化六氨合钴(Ⅲ)是一种重要的配合物原料,实验室制备三氯化六氨合钴(Ⅲ)的化学方程式为:
2CoCl2•6H2O+10NH3+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+14H2O
实验流程如图1:
已知:[Co(NH3)6]Cl3 在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
请回答下列问题:
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2•6H2O晶体,加热煮沸和研细的目的是加速固体溶解.
(2)H2O2的作用是做氧化剂,第③步中保持60℃的加热方法是水浴加热.
(3)过滤是滤纸先用蒸馏水湿润,然后用玻璃棒压实滤纸,排出滤纸与漏斗之间的气泡.
(4)实验操作1为趁热过滤,[Co(NH3)6]Cl3 溶液中加入浓HCl的目的是有利于[Co(NH3)6]Cl3析出,提高产率.
(5)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:
[Co(NH3)6]Cl3+3NaOH═Co(OH)3↓+6NH3↑+3NaCl(装置见图2),
C中装0.5000mol/L的盐酸25.00mL,D中装有冰水.加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,加入2~3滴甲基红指示剂,用0.5000mol/L的NaOH滴定.已知:
①仪器A的名称是圆底烧瓶.
②当滴定到终点时,共需消耗NaOH溶液13.00mL(精确到0.01mL)
③若用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将偏大(填“偏大”、“偏小”或“不变”).
2CoCl2•6H2O+10NH3+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+14H2O
实验流程如图1:

已知:[Co(NH3)6]Cl3 在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
| 温度(℃) | 0 | 20 | 47 |
| 溶解度(g) | 4.26 | 6.96 | 12.74 |
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2•6H2O晶体,加热煮沸和研细的目的是加速固体溶解.
(2)H2O2的作用是做氧化剂,第③步中保持60℃的加热方法是水浴加热.
(3)过滤是滤纸先用蒸馏水湿润,然后用玻璃棒压实滤纸,排出滤纸与漏斗之间的气泡.
(4)实验操作1为趁热过滤,[Co(NH3)6]Cl3 溶液中加入浓HCl的目的是有利于[Co(NH3)6]Cl3析出,提高产率.
(5)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:
[Co(NH3)6]Cl3+3NaOH═Co(OH)3↓+6NH3↑+3NaCl(装置见图2),
C中装0.5000mol/L的盐酸25.00mL,D中装有冰水.加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,加入2~3滴甲基红指示剂,用0.5000mol/L的NaOH滴定.已知:
| 指示剂 | 颜色 | 变色的pH范围 | ||
| 甲基红 | 红 | 橙 | 黄 | 4.4~6.2 |
②当滴定到终点时,共需消耗NaOH溶液13.00mL(精确到0.01mL)
③若用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将偏大(填“偏大”、“偏小”或“不变”).
6.下列过程中△H小于零的是( )
| A. | 炽热的碳与二氧化碳的反应 | B. | 氯化铵分解得氨气 | ||
| C. | 碳酸钙分解得二氧化碳 | D. | Zn与硫酸的反应 |