题目内容
如图是元素周期表的一部分,下列说法中正确的是( )


| A、元素④、⑦、⑨的单质的氧化性依次减弱,所以在水溶液中④的单质可以置换出⑦、⑨的单质 |
| B、因为氢键关系,气态氢化物的稳定性③大于⑥ |
| C、元素⑤的单质与元素②的最高价氧化物对应的水化物反应时,参加反应的⑤单质与生成氢气的物质的量之比为2:3 |
| D、离子半径:⑥>⑦>③>④>⑤ |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置知①为C、②为N、③为O、④为F、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为Br.
A.溶液中氟气与水反应生成HF与氧气,不能置换出氯气、溴单质;
B.氢键不影响化学性质;
C.Al与硝酸反应没有氢气生成;
D.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大.
A.溶液中氟气与水反应生成HF与氧气,不能置换出氯气、溴单质;
B.氢键不影响化学性质;
C.Al与硝酸反应没有氢气生成;
D.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大.
解答:
解:由元素在周期表中位置知①为C、②为N、③为O、④为F、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为Br.
A.溶液中氟气与水反应生成HF与氧气,不能置换出氯气、溴单质,故A错误;
B.氢键不影响化学性质,H-X键能影响氢化物稳定性,故B错误;
C.硝酸为氧化性酸,Al与硝酸反应没有氢气生成,故C错误;
D.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->O2->F->Al3+,故D正确,
故选D.
A.溶液中氟气与水反应生成HF与氧气,不能置换出氯气、溴单质,故A错误;
B.氢键不影响化学性质,H-X键能影响氢化物稳定性,故B错误;
C.硝酸为氧化性酸,Al与硝酸反应没有氢气生成,故C错误;
D.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->O2->F->Al3+,故D正确,
故选D.
点评:本题考查元素周期表与元素周期律等,难度中等,注意理解掌握微粒半径比较,氢键对物质性质的影响.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
石灰石是一种化工原料,可以通过反应生成一系列物质,如图.
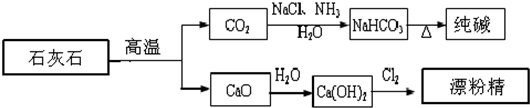
下列说法正确的是( )

下列说法正确的是( )
| A、漂粉精是混合物,主要成分是氯化钙 |
| B、图示的制纯碱方法,要求先向饱和食盐水中通NH3,然后再通CO2 |
| C、纯碱属于碱,俗名苏打 |
| D、制取纯碱和漂粉精所涉及的反应都是非氧化还原反应 |
下列溶液中氯离子浓度最大的是( )
| A、1L1mol/LAlCl3溶液中 |
| B、2L1mol/LFeCl3溶液中 |
| C、1L2mol/LKCl溶液中 |
| D、2L3mol/LMgCl2溶液中 |
常温下,AgI的溶度积是8.3×10-17,在该温度下把0.01L浓度为8.0×10-6mol/L的AgNO3溶液和0.01L浓度为4.0×10-7 mol/L的KI溶液混合,下列说法正确的是(溶液体积变化忽略不计)( )
| A、不能确定有无AgI沉淀生成 |
| B、没有AgI沉淀生成 |
| C、有KNO3晶体析出 |
| D、有AgI沉淀生成 |
已知:T℃时,CaCO3的Ksp为1.0×10-10,CaF2的Ksp为4.0×10-12下列说法正确的是( )
| A、T℃时,饱和CaCO3溶液与饱和CaF2溶液相比,后者Ca2+浓度大 |
| B、T℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,会析出CaCO3固体 |
| C、T℃时,CaF2固体在20mL0.01 mol?L-1盐酸中的Ksp比在纯水中的Ksp大 |
| D、T℃时,在CaCO3悬浊液中加入NaF固体,CaCO3不可能转化为CaF2 |
电解CuSO4溶液时,要求达到三点(1)阳极质量减少;(2)阴极质量增加;(3)电解质溶液中c(Cu2+)不变,则可选用的电极是( )
| A、纯铜作阳极,含Zn和Ag的铜合金作阴极 |
| B、含Zn和Ag的铜合金作阳极,纯铜作阴极 |
| C、用纯铁作阳极,纯铜作阴极 |
| D、用石墨作阳极,纯铜作阴极 |
一定温度下,关于PH=1的醋酸溶液的下列说法中正确的是( )
| A、加入等体积的水,c(H+)、c(OH-)都减小 |
| B、加水稀释时醋酸和水的电离度都增大 |
| C、加入少量醋酸钠固体pH 一定降低 |
| D、稀释100倍pH变为3 |
36.5%的盐酸,密度是1.19g/cm3其浓度是( )
| A、8.9mol/L |
| B、11.9 mol/L |
| C、3.65 mol/L |
| D、0.0119 mol/L |