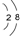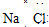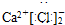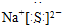题目内容
下列溶液中氯离子浓度最大的是( )
| A、1L1mol/LAlCl3溶液中 |
| B、2L1mol/LFeCl3溶液中 |
| C、1L2mol/LKCl溶液中 |
| D、2L3mol/LMgCl2溶液中 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:根据物质的化学式及物质的物质的量浓度来计算氯离子的物质的量浓度,并注意离子的浓度取决于物质的物质的量浓度,而与体积无关系.
解答:
解:A.c(Cl-)=3c(AlCl3)=3mol?L-1,故A错误;
B.c(Cl-)=3c(FeCl3)=3mol?L-1,故B错误;
C.c(Cl-)=c(KCl)=2mol?L-1,故C错误;
D.c(Cl-)=2c(MgCl2)=6mol?L-1,故D正确.
故选D.
B.c(Cl-)=3c(FeCl3)=3mol?L-1,故B错误;
C.c(Cl-)=c(KCl)=2mol?L-1,故C错误;
D.c(Cl-)=2c(MgCl2)=6mol?L-1,故D正确.
故选D.
点评:本题考查一定物质的量浓度溶液中所含微粒的物质的量浓度,难度不大,所含微粒的物质的量浓度与所取溶液的体积大小无关.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的离子积.已知下表数据:
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的下列说法,正确的是( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-36 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3 |
| A、向该混合溶液中逐滴加入NaOH溶液,最先看到的是蓝色沉淀 | ||
B、该溶液中c(S
| ||
| C、向该溶液中加入适量氯水,调节pH到4~5后过滤,可获得纯净的CuSO4溶液 | ||
| D、向该溶液中加入适量氨水,调节pH到9.6后过滤,将所得沉淀灼烧,可得等物质的量的CuO、FeO、Fe2O3三种固体的混合物 |
实验室需要配制2mol/l的NaCl溶液450ml,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
| A、450ml,52.65g |
| B、任意规格,52.65g |
| C、500 ml,58.5g |
| D、1000 ml,117g |
25℃CaCO3固体溶于水达饱和时物质的量浓度是9.327×10-5 mol/L,则CaCO3在该温度下的Ksp为( )
| A、9.3×10-5 mol/L |
| B、9.7×10-9 mol2/L2 |
| C、7.6×10-17 mol4/L4 |
| D、8.7×10-9 mol2/L2 |
如图是元素周期表的一部分,下列说法中正确的是( )


| A、元素④、⑦、⑨的单质的氧化性依次减弱,所以在水溶液中④的单质可以置换出⑦、⑨的单质 |
| B、因为氢键关系,气态氢化物的稳定性③大于⑥ |
| C、元素⑤的单质与元素②的最高价氧化物对应的水化物反应时,参加反应的⑤单质与生成氢气的物质的量之比为2:3 |
| D、离子半径:⑥>⑦>③>④>⑤ |