题目内容
A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶液呈碱性,E与C的最外层电子数相同.
(1)画出D的原子结构示意图 ,E元素在周期表中的位置是 .
(2)A与C形成的化合物中,原子个数比为1:1的化合物的结构式为 .
(3)D与C按原子个数比为1:1形成化合物的电子式是 .
(4)B、C所形成氢化物的稳定性由强到弱的顺序是 、 (填具体的化学式).
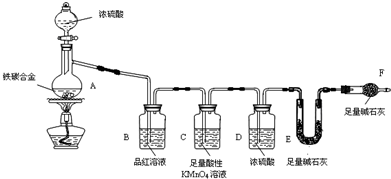
(5)F是一种历史悠久、应用广泛的金属元素.若将F金属投入到盐酸溶液中,生成了浅绿色溶液M.写出M的酸性溶液和A与 C形成的一种化合物反应的离子方程式: .
(6)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl-NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式: ;放电时溶液中H+移向 (填“正”或“负”)极.
(7)E(s)+O2(g)═EO2(g)△H1
E(g)+O2(g)═EO2(g)△H2,则△Hl △H2(填“>”或“<”或“=”).
(1)画出D的原子结构示意图
(2)A与C形成的化合物中,原子个数比为1:1的化合物的结构式为
(3)D与C按原子个数比为1:1形成化合物的电子式是
(4)B、C所形成氢化物的稳定性由强到弱的顺序是
(5)F是一种历史悠久、应用广泛的金属元素.若将F金属投入到盐酸溶液中,生成了浅绿色溶液M.写出M的酸性溶液和A与 C形成的一种化合物反应的离子方程式:
(6)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl-NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式:
(7)E(s)+O2(g)═EO2(g)△H1
E(g)+O2(g)═EO2(g)△H2,则△Hl
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种短周期主族元素中,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成的化合物,则A为H元素、D为Na元素、C为O元素;A、B组成的气态化合物的水溶液呈碱性,则B为N元素,E与C的最外层电子数相同,即E、C同主族,E为S,以此来解答.
解答:
解:A、B、C、D、E五种短周期主族元素中,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成的化合物,则A为H元素、D为Na元素、C为O元素;A、B组成的气态化合物的水溶液呈碱性,则B为N元素,E与C的最外层电子数相同,即E、C同主族,E为S,
(1)D为Na,原子结构示意图 ,E元素在周期表中的位置是第3周期第ⅥA族,故答案为:
,E元素在周期表中的位置是第3周期第ⅥA族,故答案为: ;第3周期第ⅥA族;
;第3周期第ⅥA族;
(2)A与C形成的化合物中,原子个数比为1:1的化合物为过氧化氢,其结构式为H-O-O-H,故答案为:H-O-O-H;
(3)D与C按原子个数比为1:1形成化合物为过氧化钠,其电子式是 ,
,
故答案为: ;
;
(4)非金属性越强,气态氢化物越稳定,则B、C所形成氢化物的稳定性由强到弱的顺序是H2O>NH3,故答案为:H2O;NH3;
(5)生成了浅绿色溶液M为氯化亚铁,M的酸性溶液和A与C形成的一种化合物(过氧化氢)发生氧化还原反应,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(6)该电池的正极上氮气得到电子生成铵根离子,则正极反应式N2+6e-+8H+=2NH4+,放电时溶液中H+移向正极,故答案为:N2+6e-+8H+=2NH4+;正;
(7)热化学反应方程式中只有E的状态不同,由气态变为固态放出能量,且燃烧反应为放热反应,△H<0,则△Hl>△H2,故答案为:>.
(1)D为Na,原子结构示意图
 ,E元素在周期表中的位置是第3周期第ⅥA族,故答案为:
,E元素在周期表中的位置是第3周期第ⅥA族,故答案为: ;第3周期第ⅥA族;
;第3周期第ⅥA族;(2)A与C形成的化合物中,原子个数比为1:1的化合物为过氧化氢,其结构式为H-O-O-H,故答案为:H-O-O-H;
(3)D与C按原子个数比为1:1形成化合物为过氧化钠,其电子式是
 ,
,故答案为:
 ;
;(4)非金属性越强,气态氢化物越稳定,则B、C所形成氢化物的稳定性由强到弱的顺序是H2O>NH3,故答案为:H2O;NH3;
(5)生成了浅绿色溶液M为氯化亚铁,M的酸性溶液和A与C形成的一种化合物(过氧化氢)发生氧化还原反应,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(6)该电池的正极上氮气得到电子生成铵根离子,则正极反应式N2+6e-+8H+=2NH4+,放电时溶液中H+移向正极,故答案为:N2+6e-+8H+=2NH4+;正;
(7)热化学反应方程式中只有E的状态不同,由气态变为固态放出能量,且燃烧反应为放热反应,△H<0,则△Hl>△H2,故答案为:>.
点评:本题考查位置、结构、性质及应用,为高频考点,把握元素的位置、性质及元素化合物知识推断元素为解答的关键,侧重分析与推断能力的综合考查,题目难度中等.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
设NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A、标准状况下,22.4L水所含的分子数为NA | ||||
| B、17g NH3中所含的原子个数为4NA | ||||
| C、1L、1mol/L的稀盐酸中含有的氯化氢分子数为NA | ||||
D、在反应2H2O2
|
下列说法正确的是( )
| A、第ⅥA族元素从上到下,其氢化物的稳定性逐渐减弱 |
| B、L层电子数为奇数的所有元素都是非金属元素 |
| C、ⅦA族元素阴离子的还原性越强,元素的最高价氧化物对应水化物的酸性也越强 |
| D、同一主族的甲乙两种元素,甲的原子序数为a,则乙的原子序数可能为a+4 |