题目内容
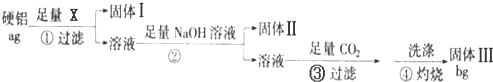
铝是用途广泛的金属材料,目前工业上主要用铝土矿(主要成分含氧化铝、氧化铁)来制取铝,其常见的过程如下:
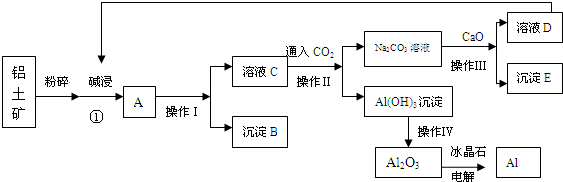
请回答下列问题:
(1)沉淀B的化学式为 ,溶液C中阴离子主要是 .
(2)操作Ⅰ是 (填操作名称)
(3)写出①过程中发生反应的离子方程式 .
(4)Al(OH)3沉淀必须进行洗涤才能通过操作Ⅳ获得纯净Al2O3,操作Ⅳ是 (填操作名称),简述洗涤沉淀的操作方法: .
(5)生产过程中,除水、CaO和CO2可以循环使用外,还可循环使用的物质有 (填化学式).
(6)电解Al2O3制取金属Al的阳极电极反应式为 .

请回答下列问题:
(1)沉淀B的化学式为
(2)操作Ⅰ是
(3)写出①过程中发生反应的离子方程式
(4)Al(OH)3沉淀必须进行洗涤才能通过操作Ⅳ获得纯净Al2O3,操作Ⅳ是
(5)生产过程中,除水、CaO和CO2可以循环使用外,还可循环使用的物质有
(6)电解Al2O3制取金属Al的阳极电极反应式为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:铝土矿(主要成分含氧化铝、氧化铁)加入氢氧化钠,氧化铁不和碱反应,氧化铝可与氢氧化钠反应生成偏铝酸钠和水;过滤后得到的沉淀B为氧化铁,滤液中含氢氧化钠和偏铝酸钠;通入二氧化碳,二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀和碳酸钠,二氧化碳和氢氧化钠反应生成碳酸钠,过滤得到氢氧化铝沉淀和碳酸钠溶液;灼烧氢氧化铝得到氧化铝和水,电解氧化铝得到铝和氧气;碳酸钠溶液和氧化钙反应生成碳酸钙和氢氧化钠,氢氧化钠用来碱浸;灼烧碳酸钙得到氧化钙和二氧化碳,二氧化碳和氧化钙循环使用.
(1)铝土矿中含氧化铁,氧化铁不和碱反应;氧化钙和水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀(E)和氢氧化钠;
(2)不溶物和溶液分开采取过滤的方法;
(3)铝土矿中含有氧化铝,可与氢氧化钠反应生成偏铝酸钠和水;
(4)氢氧化铝受热分解得到氧化铝;洗涤沉淀,可在过滤器中加入水至淹没沉淀,等水过滤后,重复操作2-3次;
(5)根据流程可以确定能循环使用的物质:对碳酸钙高温煅烧生成的氧化钙可以再和碳酸钠水溶液作用,生成的二氧化碳还可以用来处理溶液C,二者均可以循环使用,氧化钙和水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠溶液即D溶液,反应的总方程式为Na2CO3+CaO+H2O═2NaOH+CaCO3↓,氢氧化钠用来碱浸,
(6)电解池中,阳极是惰性电极时,该极上是阴离子发生失电子的氧化反应.
(1)铝土矿中含氧化铁,氧化铁不和碱反应;氧化钙和水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀(E)和氢氧化钠;
(2)不溶物和溶液分开采取过滤的方法;
(3)铝土矿中含有氧化铝,可与氢氧化钠反应生成偏铝酸钠和水;
(4)氢氧化铝受热分解得到氧化铝;洗涤沉淀,可在过滤器中加入水至淹没沉淀,等水过滤后,重复操作2-3次;
(5)根据流程可以确定能循环使用的物质:对碳酸钙高温煅烧生成的氧化钙可以再和碳酸钠水溶液作用,生成的二氧化碳还可以用来处理溶液C,二者均可以循环使用,氧化钙和水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠溶液即D溶液,反应的总方程式为Na2CO3+CaO+H2O═2NaOH+CaCO3↓,氢氧化钠用来碱浸,
(6)电解池中,阳极是惰性电极时,该极上是阴离子发生失电子的氧化反应.
解答:
解:(1)铝土矿中含氧化铁,氧化铁不和碱反应,氧化铝可与氢氧化钠反应生成偏铝酸钠和水;过滤后得到的沉淀B为氧化铁,滤液中含氢氧化钠和偏铝酸钠;
故答案为:Fe2O3;AlO2-和OH-;
(2)不溶物和溶液分开采取过滤的方法,氧化铁不和碱反应,为不溶物,氧化铝可与氢氧化钠反应生成偏铝酸钠和水,故用过滤方法把沉淀和溶液分开;故答案为:过滤;
(3)铝土矿中含有氧化铝,可与氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-═2AlO-2+H2O,
故答案为:Al2O3+2OH-═2AlO-2+H2O;
(4)氢氧化铝受热分解得到氧化铝,故操作Ⅳ是灼烧;洗涤沉淀,可在过滤器中加入水至淹没沉淀,等水自然流尽后重复操作2-3次,
故答案为:过滤;在过滤器中加入水至淹没沉淀,等水自然流尽后重复操作2-3次;
(5)对碳酸钙高温煅烧生成的氧化钙可以再和碳酸钠水溶液作用,生成的二氧化碳还可以用来处理溶液C,二者均可以循环使用,氧化钙和水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠溶液即D溶液,反应的总方程式为Na2CO3+CaO+H2O═2NaOH+CaCO3↓,氢氧化钠用来碱浸,
故答案为:NaOH;
(6)电解池中,阳极是惰性电极时,该极上是阴离子O2-发生失电子的氧化反应:2O2--4e-=O2↑,
故答案为:2O2--4e-=O2↑.
故答案为:Fe2O3;AlO2-和OH-;
(2)不溶物和溶液分开采取过滤的方法,氧化铁不和碱反应,为不溶物,氧化铝可与氢氧化钠反应生成偏铝酸钠和水,故用过滤方法把沉淀和溶液分开;故答案为:过滤;
(3)铝土矿中含有氧化铝,可与氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-═2AlO-2+H2O,
故答案为:Al2O3+2OH-═2AlO-2+H2O;
(4)氢氧化铝受热分解得到氧化铝,故操作Ⅳ是灼烧;洗涤沉淀,可在过滤器中加入水至淹没沉淀,等水自然流尽后重复操作2-3次,
故答案为:过滤;在过滤器中加入水至淹没沉淀,等水自然流尽后重复操作2-3次;
(5)对碳酸钙高温煅烧生成的氧化钙可以再和碳酸钠水溶液作用,生成的二氧化碳还可以用来处理溶液C,二者均可以循环使用,氧化钙和水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠溶液即D溶液,反应的总方程式为Na2CO3+CaO+H2O═2NaOH+CaCO3↓,氢氧化钠用来碱浸,
故答案为:NaOH;
(6)电解池中,阳极是惰性电极时,该极上是阴离子O2-发生失电子的氧化反应:2O2--4e-=O2↑,
故答案为:2O2--4e-=O2↑.
点评:本题考查物质的分离和提纯,侧重于铝的化合物的考查,难度中等,注意把握相关物质的性质以及化学方程式的书写,学习中注意相关知识的积累.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
将3mol O2加入到V L的反应器中,在高温下放电,经t1s建立了平衡体系:3O2?2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是( )
A、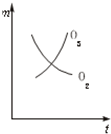 |
B、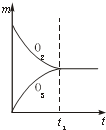 |
C、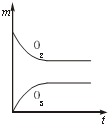 |
D、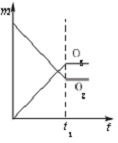 |
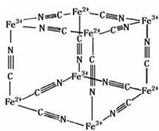 普鲁士蓝晶体结构如下图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )
普鲁士蓝晶体结构如下图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )| A、化学式可以表示为KFe2(CN)6 |
| B、一个立方体中含有12个π键 |
| C、普鲁士蓝中含有配位键 |
| D、Fe3+周围有12个Fe2+离子 |
下列图示对应的装置以及操作均正确的是( )
A、 定容 |
B、 钠的焰色反应 |
C、 蒸馏 |
D、 蒸发 |
 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸.记录数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸.记录数据如下: