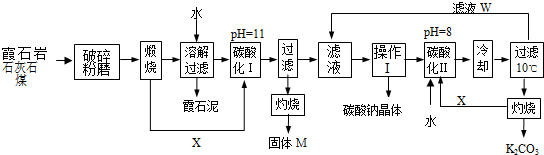
题目内容
现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究.
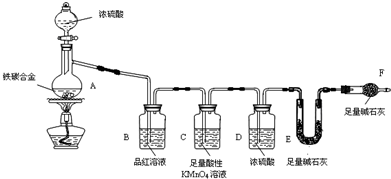
(1)装置A的名称: ;检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在F装置后面连上一根导管,然后 ,则证明装置的气密性良好.
(2)往A中滴足量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是: .
(3)装置C的现象 ;C发生反应后生成两种硫酸盐,写出C中的化学方程式 .
(4)装置F的作用 .称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g.铁碳合金中碳的质量分数为 (写表达式).
(5)某同学认为,依据此实验测得的数据有问题,因为反应产生的CO2气体未能完全排到装置E中,请问该同学的观点是否正确 (“是”或“否”);铁的质量分数会 (偏大、偏小、不变).

(1)装置A的名称:
(2)往A中滴足量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
(3)装置C的现象
(4)装置F的作用
(5)某同学认为,依据此实验测得的数据有问题,因为反应产生的CO2气体未能完全排到装置E中,请问该同学的观点是否正确
考点:浓硫酸的性质实验
专题:氧族元素
分析:(1)依据装置中的压强变化恒容液面变化分析检验,最后导气管插入水,加热发生装置导气管冒气泡,停止加热上升一段水柱;
(2)常温下铁在浓硫酸中钝化,碳和浓硫酸在加热条件下才能反应;
(3)二氧化硫具有还原性,能被高锰酸钾氧化为硫酸根离子,据此回答;
(4)碱石灰增加的质量可以确定反应中产生的二氧化碳的质量,但是不能收到空气中的水以及二氧化碳的影响,根据实验原理结合元素守恒来计算;
(5)碱石灰增加的质量可以确定反应中产生的二氧化碳的质量,应该保证全部生成的二氧化碳都被碱石灰吸收,否则产生实验误差.
(2)常温下铁在浓硫酸中钝化,碳和浓硫酸在加热条件下才能反应;
(3)二氧化硫具有还原性,能被高锰酸钾氧化为硫酸根离子,据此回答;
(4)碱石灰增加的质量可以确定反应中产生的二氧化碳的质量,但是不能收到空气中的水以及二氧化碳的影响,根据实验原理结合元素守恒来计算;
(5)碱石灰增加的质量可以确定反应中产生的二氧化碳的质量,应该保证全部生成的二氧化碳都被碱石灰吸收,否则产生实验误差.
解答:
解:铁和碳单质均可以和浓硫酸反应生成二氧化碳、二氧化硫,二氧化硫的检验可以用品红,吸收可以用高猛酸钾,将产生的二氧化碳用浓硫酸干燥,通入碱石灰,根据碱石灰增加的质量可以确定二氧化碳的质量,根据C元素守恒,可以计算碳单质的质量,进而计算铁的质量,得到铁的质量分数;
(1)装置A是蒸馏烧瓶;检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在F装置后面连上一根导管,然后把最后导气管插入水,加热发生装置导气管冒气泡,停止加热上升一段水柱证明装置气密性好;
故答案为:蒸馏烧瓶;将导气管插入水中,加热烧瓶,导气管冒气泡,停止加热有一段水柱上升;
(2)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,常温下铁在浓硫酸中钝化,碳和浓硫酸在加热条件下才能反应;
故答案为:常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应,故无明显现象;
(3)装置C是利用高锰酸钾溶液的强氧化性吸收二氧化硫,二氧化硫具有还原性,能被高锰酸钾氧化为硫酸根离子,5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4 ,看到高锰酸钾颜色变浅,故答案为:颜色变浅;5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4;
(4)碱石灰增加的质量可以确定反应中产生的二氧化碳的质量,但是不能收到空气中的水以及二氧化碳的影响,装置F防止外界空气中CO2、水蒸气进入E管;E增重b g,即生成二氧化碳的质量是bg,根据碳元素守恒,所以混合物中含有碳单质的质量是
×12g/mol=
g,所以铁碳合金中碳的质量分数为
×100%,故答案为:防止外界空气中CO2、水蒸气进入E管;
×100%;
(5)反应产生的CO2气体未能完全排到装置E中,则E增加的质量偏小,所以碳的质量会偏小,铁的质量分数会偏高,故答案为:是;偏大.
(1)装置A是蒸馏烧瓶;检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在F装置后面连上一根导管,然后把最后导气管插入水,加热发生装置导气管冒气泡,停止加热上升一段水柱证明装置气密性好;
故答案为:蒸馏烧瓶;将导气管插入水中,加热烧瓶,导气管冒气泡,停止加热有一段水柱上升;
(2)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,常温下铁在浓硫酸中钝化,碳和浓硫酸在加热条件下才能反应;
故答案为:常温下Fe在浓硫酸中钝化,碳不与浓硫酸反应,故无明显现象;
(3)装置C是利用高锰酸钾溶液的强氧化性吸收二氧化硫,二氧化硫具有还原性,能被高锰酸钾氧化为硫酸根离子,5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4 ,看到高锰酸钾颜色变浅,故答案为:颜色变浅;5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4;
(4)碱石灰增加的质量可以确定反应中产生的二氧化碳的质量,但是不能收到空气中的水以及二氧化碳的影响,装置F防止外界空气中CO2、水蒸气进入E管;E增重b g,即生成二氧化碳的质量是bg,根据碳元素守恒,所以混合物中含有碳单质的质量是
| bg |
| 44g/mol |
| 12b |
| 44 |
| 12b |
| 44a |
| 12b |
| 44a |
(5)反应产生的CO2气体未能完全排到装置E中,则E增加的质量偏小,所以碳的质量会偏小,铁的质量分数会偏高,故答案为:是;偏大.
点评:本题考查了物质性质的探究实验方法,装置的特征分析,流程反应和试剂作用是解题关键,题目难度中等.

练习册系列答案
相关题目
下列离子在给定的条件下能大量共存的是( )
| A、饱和氯水中:Cl-、NO3-、Na+、SO32- | ||
B、常温下,
| ||
| C、0.1 mol/L的NaOH溶液中:K+、AlO2-、SO42-、CO32- | ||
| D、在PH=7的溶液中:Fe3+、Na+、Br-、Cl- |
用NA表示阿伏加德罗常数,下列叙述错误的是 ( )(用字母填写)
| A、标准状况下,22.4LH2含有的分子数为NA |
| B、常温常压下,10.6gNa2C03含有的Na+数为0.1NA |
| C、通常状况下,NA个C02分子占有的体积大于22.4L |
| D、物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA |
下列反应的离子方程式正确的是( )
| A、SO2通入酸性KMnO4溶液,褪色:2MnO4-+4H++5SO2═2Mn2++5SO42-+2H2O | ||||
| B、氯化铝溶液通入过量氨水:Al3++4OH-=AlO2-+2H2O | ||||
C、NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3-+2OH-
| ||||
| D、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
下列对物质的分类不正确的是( )
| A、H2SO4-酸 |
| B、NaOH-碱 |
| C、HClO-氧化物 |
| D、KI-盐 |
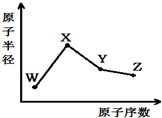 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.