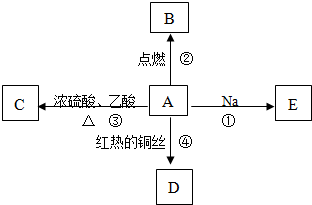
题目内容
实验室从含碘废液(除H2O外,还含有CCl4、I2、I-)中回收碘,其实验过程如图1:
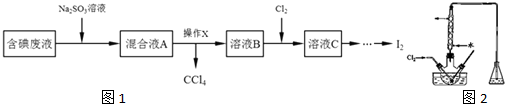
(1)向含碘废液中加入稍过量的Na2SO3溶液时发生的离子方程式为 ;该操作的目的是 .
(2)操作X应在 (填写仪器名称图2)中进行,简述得到溶液B的过程:将混合溶液静置后,
(3)在三颈瓶中将溶液B用盐酸调至pH约为2,缓慢通入Cl2,在40?C左右反应(实验装置如右图所示).实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 (填溶质的化学式).
(4)某含碘废水(pH约为4)中一定存在I2,可能存在I-或IO3-.可以使用 (填溶质的化学式,下同)溶液检验可能存在的I-或 溶液检验可能存在的IO3-.在检验该含碘废水中是否含有I-或IO3-前必需要进行的操作是 (填序号).
a.取适量含碘废水用CCl4多次萃取、分液
b.用NaOH溶液将溶液调节到中性
c.向溶液中滴入少量淀粉溶液.

(1)向含碘废液中加入稍过量的Na2SO3溶液时发生的离子方程式为
(2)操作X应在
(3)在三颈瓶中将溶液B用盐酸调至pH约为2,缓慢通入Cl2,在40?C左右反应(实验装置如右图所示).实验控制在较低温度下进行的原因是
(4)某含碘废水(pH约为4)中一定存在I2,可能存在I-或IO3-.可以使用
a.取适量含碘废水用CCl4多次萃取、分液
b.用NaOH溶液将溶液调节到中性
c.向溶液中滴入少量淀粉溶液.
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘;碘不容易溶于水,但碘离子易溶于水;
(2)分离互不相溶的液体采用分液的方法分离,结合非农业实验基本操作步骤回答得到溶液的方法;
(3)碘易升华,且氯气的溶解度随着温度的升高而减小;氯气、碘蒸气都能和氢氧化钠溶液反应生成无毒物质;
(4)碘离子具有还原性,能被氧化剂氧化生成碘,碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色.
(2)分离互不相溶的液体采用分液的方法分离,结合非农业实验基本操作步骤回答得到溶液的方法;
(3)碘易升华,且氯气的溶解度随着温度的升高而减小;氯气、碘蒸气都能和氢氧化钠溶液反应生成无毒物质;
(4)碘离子具有还原性,能被氧化剂氧化生成碘,碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色.
解答:
解:(1)碘具有氧化性,能氧化亚硫酸钠生成硫酸钠,自身被还原生成碘,离子反应方程式为SO32-+I2+H2O=2I-+2H++SO42-;碘不容易溶于水,但碘离子易溶于水,为了使更多的I元素进入水溶液应将碘还原为碘离子,
故答案为:SO32-+I2+H2O=2I-+2H++SO42-;使四氯化碳中的碘进入水层;
(2)四氯化碳属于有机物、水属于无机物,二者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法,实验仪器为分液漏斗,得到溶液的操作为:将混合溶液静置后,打开分液漏斗上部盖子,旋开活塞,放出下部液体.待下部液体完全分离后,关闭活塞,从上部倒出剩余液体;
故答案为:分液漏斗;将混合溶液静置后,打开分液漏斗上部盖子,旋开活塞,放出下部液体.待下部液体完全分离后,关闭活塞,从上部倒出剩余液体;
(3)碘易升华,且氯气的溶解度随着温度的升高而减小,温度越高,氯气的溶解度越小,反应越不充分,所以应该在低温条件下进行反应;氯气、碘蒸气都有毒,不能直接排空,且都能和氢氧化钠溶液反应生成无毒物质,所以用NaOH溶液吸收氯气和碘蒸气,
故答案为:使氯气在溶液中有较大的溶解度(或防止碘升华或防止碘进一步被氧化);NaOH溶液;
(4)碘离子具有还原性,能被氧化剂氧化生成碘,碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色,所以其检验方法为:
从水层取少量溶液,加入1-2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,2I-+2Fe3+=2Fe2++I2,若溶液变蓝色,说明废水中含有I-,否则不含I-;
另从水层取少量溶液,加入1-2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,5SO32-+2 IO3-+2H+=I2+5SO42-+H2O,若溶液变蓝色,说明废水中含有IO3-,否则不含IO3-,在检验该含碘废水中是否含有I-或IO3-前必需要进行的操作是取适量含碘废水用CCl4多次萃取、分液,向溶液中滴入少量淀粉溶液依据是否变蓝验证离子的存在;
故答案为:FeCl3 ,Na2SO3,ac;
故答案为:SO32-+I2+H2O=2I-+2H++SO42-;使四氯化碳中的碘进入水层;
(2)四氯化碳属于有机物、水属于无机物,二者不互溶,分离互不相溶的液体采用分液的方法分离,所以分离出四氯化碳采用分液的方法,实验仪器为分液漏斗,得到溶液的操作为:将混合溶液静置后,打开分液漏斗上部盖子,旋开活塞,放出下部液体.待下部液体完全分离后,关闭活塞,从上部倒出剩余液体;
故答案为:分液漏斗;将混合溶液静置后,打开分液漏斗上部盖子,旋开活塞,放出下部液体.待下部液体完全分离后,关闭活塞,从上部倒出剩余液体;
(3)碘易升华,且氯气的溶解度随着温度的升高而减小,温度越高,氯气的溶解度越小,反应越不充分,所以应该在低温条件下进行反应;氯气、碘蒸气都有毒,不能直接排空,且都能和氢氧化钠溶液反应生成无毒物质,所以用NaOH溶液吸收氯气和碘蒸气,
故答案为:使氯气在溶液中有较大的溶解度(或防止碘升华或防止碘进一步被氧化);NaOH溶液;
(4)碘离子具有还原性,能被氧化剂氧化生成碘,碘酸根离子具有氧化性,能被还原剂还原生成碘,碘遇淀粉试液变蓝色,所以其检验方法为:
从水层取少量溶液,加入1-2mL淀粉溶液,加入盐酸酸化,滴加FeCl3溶液,2I-+2Fe3+=2Fe2++I2,若溶液变蓝色,说明废水中含有I-,否则不含I-;
另从水层取少量溶液,加入1-2mL淀粉试液,加盐酸酸化,滴加Na2SO3溶液,5SO32-+2 IO3-+2H+=I2+5SO42-+H2O,若溶液变蓝色,说明废水中含有IO3-,否则不含IO3-,在检验该含碘废水中是否含有I-或IO3-前必需要进行的操作是取适量含碘废水用CCl4多次萃取、分液,向溶液中滴入少量淀粉溶液依据是否变蓝验证离子的存在;
故答案为:FeCl3 ,Na2SO3,ac;
点评:本题以物质的制备为载体考查了氧化还原反应、离子的检验、物质的分离和提纯,明确物质的性质是解本题关键,根据物质的特殊性质、混合物分离和提纯方法的选取等方面来分析解答,知道碘的检验方法,题目难度中等.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数,下列叙述错误的是 ( )(用字母填写)
| A、标准状况下,22.4LH2含有的分子数为NA |
| B、常温常压下,10.6gNa2C03含有的Na+数为0.1NA |
| C、通常状况下,NA个C02分子占有的体积大于22.4L |
| D、物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA |
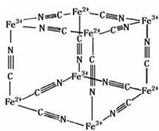 普鲁士蓝晶体结构如下图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )
普鲁士蓝晶体结构如下图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )| A、化学式可以表示为KFe2(CN)6 |
| B、一个立方体中含有12个π键 |
| C、普鲁士蓝中含有配位键 |
| D、Fe3+周围有12个Fe2+离子 |

 A、B、C、D、E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示:
A、B、C、D、E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示: