题目内容
20.在室温下,下列五种溶液:①0.1mol/LNH4Cl
②0.1mol/L CH3COONH4
③0.1mol/L NH4HSO4
④0.1mol/LNH3•H2O和0.1mol/L NH4Cl混合液
⑤0.1mol/L NH3•H2O请根据要求填写下列空白:
(1)溶液①呈酸性(填“酸”、“碱”或“中”),其原因是NH4++H2O?NH3•H2O+H+.(用离子方程式表示)
(2)比较溶液②、③中c(NH4+)的大小关系是②<③(填“>”、“<”或“=”).
(3)在溶液④中,NH3•H2O和NH4+离子的量浓度之和为0.2mol/L(填离子符号).
(4)室温下,测得溶液②的pH=7,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)=c(NH4+)(填“>”、“<”或“=”).
分析 (1)氯化铵是强酸弱碱盐,水解溶液呈酸性,铵根离子水解生成一水合氨和氢离子;
(2)醋酸根离子水解促进铵根离子水解,NH4HSO4 溶液中的氢离子抑制铵根离子的水解;
(3)依据溶液中氮元素的物料守恒计算得到;
(4)醋酸根离子水解程度和铵根离子水解程度相同,溶液呈中性,依据溶液中电荷守恒分析判断.
解答 (1)氯化铵是强酸弱碱盐,铵根离子水解显酸性;水解离子方程式为:NH4++H2O?NH3•H2O+H+;
故答案为:酸;NH4++H2O?NH3•H2O+H+;
(2)②0.1mol/L CH3COONH4 醋酸根离子水解促进铵根离子水解,铵根离子浓度小于0.1mol/L;③0.1mol/L NH4HSO4 溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈酸性溶液②、③中c(NH4+)的大小关系是小于,
故答案为:<;
(3)根据氮元素守恒得到NH3•H2O和NH4+浓度为0.2mol/L;
故答案为:NH4+;
(4)常温下,测得溶液②的pH=7,说明0.1mol/L CH3COONH4 溶液中醋酸根离子和铵根离子水解程度相同;溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+),PH=7说明溶液中c(OH-)=(H+),得到:c(CH3COO-)=c(NH4+);
故答案为:=.
点评 本题考查了盐类水解的应用,溶液中离子浓度的比较,水解平衡的变化分析,溶液中的电荷守恒应用,题目难度中等,侧重于考查学生的分析能力.

练习册系列答案
相关题目
15.下列各种情况,有机物同分异构体数目最多的是( )
| A. | 甲苯苯环上的一个氢原子被-C3H7的烷基取代 | |
| B. | C5H12被C12取代生成的一氯代物 | |
| C. | 与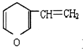 互为同分异构体的芳香族化合物 互为同分异构体的芳香族化合物 | |
| D. | 菲( 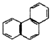 )的一硝基取代物 )的一硝基取代物 |
5.下列说法不正确的是( )
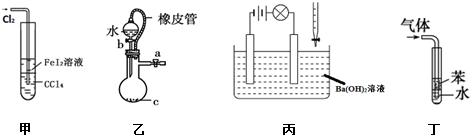

| A. | 甲装置可以用于比较Fe3+、I2、Cl2的氧化性强弱 | |
| B. | 乙装置中打开分液漏斗活塞,水不能顺利流下,说明该装置气密性良好 | |
| C. | 丙装置中若向Ba(OH)2溶液中逐滴加入硫酸溶液直至过量,灯光会由亮变暗至熄灭后又逐渐变亮 | |
| D. | 丁装置不能用于吸收HCl气体及防倒吸 |
12.下列正确的是( )
| A. | 碳酸的电离:H2CO3?H++HCO3- | B. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | ||
| C. | Na2CO3溶液中:c(HCO3-)>c(OH-) | D. | NH4Cl溶液中,c(NH4+)>c(Cl-) |
9.X、Y、Z三种元素的原子,其最外层电子排布分别为3s1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式为( )
| A. | X2YZ3 | B. | XYZ2 | C. | X2YZ2 | D. | XYZ3 |
10.化学反应可以从不同的角度进行分析,以下观点中正确的是( )
| A. | 放热反应在常温下均能自发进行 | |
| B. | 原电池工作时所发生的反应一定有氧化还原反应 | |
| C. | 加热时,化学反应只向吸热反应方向进行 | |
| D. | 化学平衡常数的表达式与化学反应方程式的书写无关 |


 +2H2O.
+2H2O.