题目内容
11.某同学设计了一个乙醇(CH3CH2OH)燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如1图: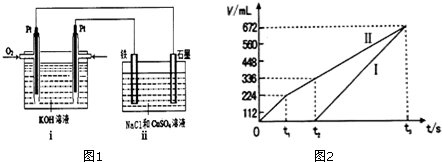
①写出ⅰ中通入乙醇这一极的电极反应式CH3CH2OH-12e-+16OH-=2CO32-+11H2O.
②25℃,1.01×105Pa时23g液态乙醇完全燃烧,当恢复至原状态时,放出362.9kJ热量,写出乙醇燃烧热的热化学方程式:CH3CH2OH (l)+3O2(g)=2CO2(g)+3H2O(l)△H=-725.8KJ/mol.
③理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图2所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式4OH--4e-=O2↑+2H2O;原混合液中CuSO4溶液物质的量浓度为0.1 mol/L.
分析 ①乙醇发生氧化反应,在碱性条件下生成碳酸根离子与水;
②23g 液态乙醇完全燃烧,当恢复到原状态时,放出362.9kJ的热量,则1mol 液态乙醇完全燃烧,当恢复到原状态时,放出725.8kJ的热量,据此书写;
③原电池通入乙醇的为负极,乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,阴极2Cu2++4e-=2Cu,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极2Cu2++4e-=2Cu,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极4H++4e-=2H2↑,所以t1~t2 阳极上生成氧气,根据氧气的量计算氢氧根离子的物质的量,水电离出等物质的量的氢离子和氢氧根离子,根据t1前生成氯气、氧气的体积计算硫酸铜的物质的量和浓度.
解答 解:①在燃料电池的中,负极上是燃料发生失电子的氧化反应,在碱性环境下,乙醇失电子的过程为:CH3CH2OH-12e-+16OH-=2CO32-+11H2O,
故答案为:CH3CH2OH-12e-+16OH-=2CO32-+11H2O;
②23g 液态乙醇完全燃烧,即0.5mol乙醇,当恢复到原状态时,放出362.9kJ的热量,则1mol 液态乙醇完全燃烧,当恢复到原状态时,放出725.8kJ的热量,即热化学方程式为:CH3CH2OH (l)+3O2(g)=2CO2(g)+3H2O(l)△H=-725.8KJ/mol,
故答案为:CH3CH2OH (l)+3O2(g)=2CO2(g)+3H2O(l)△H=-725.8KJ/mol;
③乙中石墨电极为阳极、铁电极为阴极,开始Cl-在阳极放电生成氯气,阴极Cu2+放电生成Cu,故图丙中Ⅰ表示阴极产生的气体,Ⅱ表示阳极产生的气体,t1前电极反应式为:阳极2Cl--4e-=Cl2↑,t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,t2点后电极反应式为:阳极4OH--4e-=O2↑+2H2O,所以在t1后,石墨电极上的电极反应式为4OH--4e-=O2↑+2H2O;
0~t2电极反应式为:阳极2Cl--4e-=Cl2↑,阴极Cu2++2e-=Cu,n(Cl2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,则阴极生成的Cu为0.01mol;t1~t2电极反应式为:阳极4OH--4e-=O2↑+2H2O,阴极Cu2++2e-=Cu,n(O2)=$\frac{0.0112L}{22.4mol/L}$=0.005mol,由电子守恒可知生成的铜为0.01mol,所以电解时共生成Cu为0.02mol,则原混合液中CuSO4溶液物质的量浓度为c(CuSO4)=$\frac{0.02mol}{0.2L}$=0.1mol/L;
故答案为:4OH--4e-=O2↑+2H2O;0.1.
点评 本题考查了热化学方程式、电解池原理等知识点,电解硫酸铜和氯化钠混合溶液时,明确离子的放电顺序是解本题的关键,难度较大,侧重于考查学生的分析能力和计算能力.

| A. | 因乙烯和苯分子中都含有碳碳双键,故而它们都能使溴水褪色 | |
| B. | 鉴别己烯和甲苯,可以通过分别向它们中滴入酸性KMnO4溶液 | |
| C. | 高分子材料、盐酸、水煤气、沼气、石油等是混合物,而C3H8一定是纯净物 | |
| D. | 将乙烯通入溴水中,溴水褪色,是因为发生了取代反应 |
| A. | 分子组成满足CnH2n-6的化合物一定属于芳香烃 | |
| B. | 甲苯与混酸作用一次可向苯环中引入三个-NO2,而苯只能引入一个-NO2,说明甲苯的化学活泼性比苯强 | |
| C. | 二甲苯有四种同分异构体,它们被高锰酸钾酸性溶液氧化后都能生成二元芳香酸 | |
| D. | 2,4,6三硝基甲苯,俗称TNT,是一种黄色烈性炸药. |
①石油裂解得到的汽油是纯净物
②石油裂解能得到乙烯,乙烯是生产聚乙烯的原料
③天然气是一种清洁的化石燃料
④用酸性高锰酸钾溶液鉴别四氯化碳、环己烯和环己烷
⑤石油产品都可用于聚合反应
⑥甲烷、苯都属于烃,都不存在同分异构体
⑦煤液化后可以得到甲醇
⑧葡萄糖水解制得乙醇,乙醇氧化可得到乙醛
⑨煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来.
| A. | ③④⑥⑦⑧⑨ | B. | ②③④⑦ | C. | ③④⑤⑥⑦⑧ | D. | ③④⑦⑧ |
| A. | CH4中混有C2H4,可通过KMnO4酸性溶液除去CH4中C2H4 | |
| B. | 苯与液溴在铁粉催化下反应生成有苦杏仁味的溴苯 | |
| C. | 除去乙醇中的水可先加生石灰,再蒸馏 | |
| D. | 己烷与苯的混合溶液可用分液法分离 |
①由乙烯、氢气制取乙烷、由乙烷、溴(气体)制溴乙烷
②乙烯使溴水褪色、乙炔使酸性高锰酸钾水溶液褪色
③由乙醇、乙酸制乙酸乙酯、由甘氨酸制得二肽
④由乙烯、氯化氢制取氯乙烷、由乙炔、氯化氢制取氯乙烯.
| A. | 只有②③ | B. | 只有③④ | C. | 只有①③ | D. | 只有①④ |
| A. | 负极反应为:O2+2H2O+4e-═4OH- | |
| B. | 负极反应为:2H2+4OH--4e-═4H2O | |
| C. | 电池工作时溶液中的阴离子移向正极 | |
| D. | 电池工作时负极区pH升高,正极区pH下降 |
| A. | ①②③④ | B. | ②①③④ | C. | ④①③② | D. | ③①②④ |