题目内容
实验室制备、收集干燥的SO2,所需仪器如图.
(1)装置A产生SO2,按气流方向连接各仪
器接口,顺序为a→ → → → →f.
(2)验证产生的气体是SO2的方法及实验现象是

(1)装置A产生SO2,按气流方向连接各仪
器接口,顺序为a→
(2)验证产生的气体是SO2的方法及实验现象是

考点:常见气体制备原理及装置选择
专题:
分析:(1)利用实验仪器的连接,铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水;安全瓶的使用以及尾气吸收来分析;
(2)二氧化硫的验证,利用其特殊性质漂白性来分析.
(2)二氧化硫的验证,利用其特殊性质漂白性来分析.
解答:
解:(1)收集二氧化硫应先干燥再收集,故先通过d、e,二氧化硫的密度比空气大,要从c口进气,b口出来进行尾气处理.因为二氧化硫易于氢氧化钠反应,故f的作用是安全瓶,防止倒吸;盛放NaOH溶液的烧杯为尾气处理装置要放置在最后;
故答案为:d;e;c;b;
(2)检验二氧化硫的一般方法是将气体通入品红溶液中,如果品红褪色,加热后又恢复红色,证明有二氧化硫,故答案为:将气体通入品红溶液中,如果品红褪色,加热后又恢复红色.
故答案为:d;e;c;b;
(2)检验二氧化硫的一般方法是将气体通入品红溶液中,如果品红褪色,加热后又恢复红色,证明有二氧化硫,故答案为:将气体通入品红溶液中,如果品红褪色,加热后又恢复红色.
点评:本题考查了气体的实验室制法,要熟练掌握反应原理、发生装置的选择、收集装置的选择.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
下列离子方程式书写正确的是( )
A、酸性高锰酸钾与少量双氧水反应:2MnO
| ||||
B、用石墨电极电解饱和MgCl2溶液:2Cl-+2H2O
| ||||
C、Mg(HCO3)2溶液与过量的NaOH溶液反应:Mg2++HCO
| ||||
| D、向NaClO溶液中通入过量CO2;CO2+ClO-+H2O=HCO3-+HClO |
常温下,下列各组离子在指定的溶液中一定能大量共存的是( )
| A、使酚酞变红的溶液:Na+、Cu2+、Cl-、HCO3- |
| B、使石蕊变红的溶液:K+、Fe3+、NO3-、I- |
| C、0.1mol/L的NaCl溶液.Al3+、NH4+、SO42-、NO3- |
| D、pH=1的硫酸溶液:Ba2+、K+、OH-、CH3COO- |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、1 mol甲烷中含有10NA个质子 |
| B、27g铝被完全氧化成氧化铝,失去2NA个电子 |
| C、标准状况下,22.4 L苯含有NA个C6H6分子 |
| D、常温常压下,28g乙烯含有2NA个碳碳双键 |
铟产业被称为“信息时代的朝阳产业”.元素周期表中铟的数据见图,下列说法完全正确的是( )


| A、铟元素的质量数是114.8 |
| B、铟元素的相对原子质量是115,中子数为66 |
| C、铟元素是一种主族元素,位于第五周期第ⅢA族 |
| D、铟原子最外层有3个能量相同的电子 |
根据原子结构及元素周期律的知识,下列推断正确的是( )
A、
| ||||
| B、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| C、同周期元素(除0族元素外)从左到右,原子半径逐渐减小 | ||||
| D、若M+和R2-的核外电子层结构相同,则原子序数R>M |
MgCl2和NaHCO3按物质的量之比为1:2混合制成溶液,加热蒸干灼烧后得到的固体是( )
| A、Mg(HCO3)2、NaCl |
| B、MgO、NaCl |
| C、MgCl2、Na2CO3 |
| D、MgCO3、NaCl |
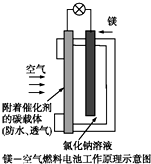 镁燃料电池作为一种高能化学电源,具有良好的应用前景.如图是镁-空气燃料电池工作原理示意图.下列有关该电池的说法正确的是( )
镁燃料电池作为一种高能化学电源,具有良好的应用前景.如图是镁-空气燃料电池工作原理示意图.下列有关该电池的说法正确的是( )| A、该电池Mg作负极,发生还原反应 |
| B、该电池的正极反应式为:O2+2H2O+4e-=4OH- |
| C、电池工作时,电子通过导线由碳电极流向Mg电极 |
| D、当电路中通过0.2 mol电子时,消耗的O2体积为1.12 L |
下列关于核外电子的描述中,正确的是( )
| A、电子云图中一个小黑点表示一个电子 |
| B、电子式中元素符号周围的小黑点数表示核外电子总数 |
| C、s电子在s电子云的球形空间内做规则运动 |
| D、核外电子的能量大小主要是由电子层和电子亚层决定 |