题目内容
某有机物在气态时与相同状况下的H2的密度比为30:1,12g该有机物与足量钠放出0.2g H2,不能发生银镜反应,符合条件的有机物可能有 .
考点:有机物实验式和分子式的确定
专题:有机物分子组成通式的应用规律
分析:该有机物在气态时对H2的相对密度为30,则其摩尔质量为60g/mol,据此可以计算出12.0g该有机物的物质的量,该有机物不能发生银镜反应,说明无醛基,再根据该有机物能够与金属钠反应生成氢气的物质的量,确定含羟基或羧基的个数,据此确定该有机物的结构简式.
解答:
解:该有机物在气态时对H2的相对密度为30,则其摩尔质量为:2g/mol×30=60g/mol.
由于该有机物能够与金属钠反应生成氢气,则其分子中含有官能团羟基或羧基,
则12g该有机物的物质的量为
=0.2mol,
0.2g氢气的物质的量为:n(H2)=
=0.1mol,则该有机物分子中含1羟基或一个羧基,
若含羟基,则60-17=43,除羟基外,还有基团-C3H7,若含羧基,60-45=15,除羧基外,还含基团-CH3,故该有机物的结构简式为CH3COOH,
所以该有机物的结构简式可能为:CH3CH2CH2OH、CH3CH(OH)CH3、CH3COOH.
故答案为:CH3CH2CH2OH、CH3CH(OH)CH、CH3COOH.
由于该有机物能够与金属钠反应生成氢气,则其分子中含有官能团羟基或羧基,
则12g该有机物的物质的量为
| 12g |
| 60g/mol |
0.2g氢气的物质的量为:n(H2)=
| 0.2g |
| 2g/mol |
若含羟基,则60-17=43,除羟基外,还有基团-C3H7,若含羧基,60-45=15,除羧基外,还含基团-CH3,故该有机物的结构简式为CH3COOH,
所以该有机物的结构简式可能为:CH3CH2CH2OH、CH3CH(OH)CH3、CH3COOH.
故答案为:CH3CH2CH2OH、CH3CH(OH)CH、CH3COOH.
点评:本题考查了有机物分子式、结构简式确定的计算,题目中等难度,注意掌握确定有机物分子式、结构简式的方法,根据有机物性质确定有机物分子中存在的官能团为解答本题的关键.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成2 mol NaOH |
| B、原电池中阳离子向正极移动 |
| C、充电时,把铅蓄电池的负极接在外电源的正极 |
| D、电解过程中,阴极质量一定增加 |
下列说法正确的是( )
| A、物质发生化学反应都伴随着能量变化 |
| B、伴有能量变化的物质变化都是化学变化 |
| C、在一个化学反应中,反应物的总能量与生成物的总能量一定相同 |
| D、在一个化学反应中,反应物的总能量一定高于生成物的总能量 |
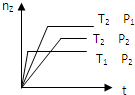 反应2X(?)+Y(g)?2Z(g)△H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
反应2X(?)+Y(g)?2Z(g)△H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )| A、△H>0,X为气体 |
| B、△H>0,X为固体 |
| C、△H<0,X为气体 |
| D、△H<0,X为固体 |
在含10.6g纯碱的稀溶液中,逐滴加入含0.06mol氯化氢的稀盐酸,并不断搅拌,充分反应后在标准状况下生成CO2的体积为( )
| A、2.24 L |
| B、1.344L |
| C、0.672L |
| D、0 L |
向某稀硝酸溶液中加入5.6g铁粉,充分反应后,铁粉全部溶解并放出NO气体,溶液质量增加3.4g,则所得溶液中Fe2+、Fe3+的物质的量浓度之比为( )
| A、1:1 | B、2:1 |
| C、3:2 | D、4:1 |
下列实验操作中正确的是( )
| A、蒸发氯化钠溶液时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、蒸馏石油时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、分液操作时,下层液体从分液漏斗下口放出,上层液体从下口放出到另一个烧杯 |
| D、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |