题目内容
下列叙述正确的是( )
| A、用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成2 mol NaOH |
| B、原电池中阳离子向正极移动 |
| C、充电时,把铅蓄电池的负极接在外电源的正极 |
| D、电解过程中,阴极质量一定增加 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、电解饱和氯化钠反应方程式为2NaCl+2H2O
2NaOH+Cl2↑+H2↑,根据氢氧化钠和转移电子之间的关系式计算;
B、原电池中阳离子向正极移动,阴离子向负极移动;
C、充电时,把铅蓄电池的负极接在外电源的负极;
D、电解过程中,阴极发生还原反应,如果是氢离子放电,质量不是增加.
| ||
B、原电池中阳离子向正极移动,阴离子向负极移动;
C、充电时,把铅蓄电池的负极接在外电源的负极;
D、电解过程中,阴极发生还原反应,如果是氢离子放电,质量不是增加.
解答:
解:A、电解饱和氯化钠反应方程式为2NaCl+2H2O
2NaOH+Cl2↑+H2↑,若有1mol电子转移,则生成0.5mol氯气生成,所以生成1molNaOH,故A错误;
B、原电池中阳离子向正极移动,故B正确;
C、充电时,负极与外接电源的负极相连,则充电时,把铅蓄电池的负极接在外电源的负极,故C错误;
D、电解过程中,阴极发生还原反应,如果是氢离子放电,质量不增加,故D错误;
故选B.
| ||
B、原电池中阳离子向正极移动,故B正确;
C、充电时,负极与外接电源的负极相连,则充电时,把铅蓄电池的负极接在外电源的负极,故C错误;
D、电解过程中,阴极发生还原反应,如果是氢离子放电,质量不增加,故D错误;
故选B.
点评:本题考查了原电池和电解池原理,明确各个电极上发生的反应是解本题关键,再结合物质之间的关系式计算,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、当分子间距离增大时,分子间的引力增大、斥力减小 |
| B、温度是系统中分子总动能大小的标志 |
| C、布朗运动指的是悬浮小颗粒的无规则运动 |
| D、当系统与外界没有热交换时,温度一定保持不变 |
下列变化中,属于化学变化的是( )
| A、用苯从溴水中萃取溴 |
| B、重油裂化得到轻质燃料油 |
| C、碘的升华 |
| D、石油分馏得到汽油、煤油等产物 |
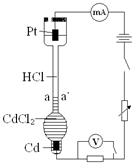 设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu).恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa′处形成清晰的界面.通电后,可观察到清晰界面缓缓向上移动.下列说法正确的是( )
设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu).恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa′处形成清晰的界面.通电后,可观察到清晰界面缓缓向上移动.下列说法正确的是( )| A、通电时,H+、Cd2+向Cd电极迁移,Cl-向Pt电极迁移 | ||||
| B、一定时间内,如果通过HCl溶液某一界面的总电量为1.0 C,测得H+所迁移的电量为0.82 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍 | ||||
| C、如果电源正负极反接,则下端产生大量Cl2,使界面不再清晰,实验失败 | ||||
D、装置中总反应的化学方程式为:2HCl
|
下列关于电解质溶液中离子浓度关系的说法正确的是( )
| A、0.1mol/L的NaHCO3溶液中离子浓度的关系:c(Na+)═c(HCO3-)+c(H2CO3)+2c(CO32-) |
| B、0.1mol/L的NH4Cl溶液和0.1mol/L的NH3?H2O等体积混合后离子浓度的关系:c(NH4+)>c( Cl-)>c(OH-)>c(H+) |
| C、常温下,物质的量浓度相等的醋酸溶液与氢氧化钠溶液等体积混合,所得溶液PH=7 |
| D、KHS溶液中存在等式关系:c(S2-)+c(OH-)=c(H+)+c(H2S) |
在隔绝空气的情况下,9.8g铁镁铝混合物溶解在一定量某浓度的稀硝酸中,当金属完全溶解后收集到4.48L(标准状况下)NO气体.在反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量可能为( )
| A、18g | B、20g |
| C、22g | D、24g |
向2L密闭容器中加入2molNH3和3molO2发生反应4NH3(g)+5O2(g))=4NO(g)+6H2O(g)半分钟后,测的NH3剩余1mol,下列说法不正确的是( )
| A、该反应生成了1.5mol的水蒸气 |
| B、用O2表示该反应速率为2.5mol/(L?min) |
| C、反应后容器中NO的浓度为0.5mol/L |
| D、反应后容器中n(NH3)=n(NO) |