题目内容
向某稀硝酸溶液中加入5.6g铁粉,充分反应后,铁粉全部溶解并放出NO气体,溶液质量增加3.4g,则所得溶液中Fe2+、Fe3+的物质的量浓度之比为( )
| A、1:1 | B、2:1 |
| C、3:2 | D、4:1 |
考点:化学方程式的有关计算,硝酸的化学性质
专题:计算题
分析:溶液质量增重等于Fe的质量与NO质量之差,据此计算NO的质量,结合电子转移守恒及Fe的质量列方程计算n(Fe2+)、(Fe3+).
解答:
解:n(Fe)=
=0.1mol,生成NO的质量为5.6g-3.4g=2.2g,
设Fe2+和Fe3+物质的量分别为x、y,则:
,
解得x=0.08mol,y=0.02mol,
所以所得溶液中Fe2+和Fe3+物质的量之比为0.08mol:0.02mol=4:1,
故选D.
| 5.6g |
| 56g/mol |
设Fe2+和Fe3+物质的量分别为x、y,则:
|
解得x=0.08mol,y=0.02mol,
所以所得溶液中Fe2+和Fe3+物质的量之比为0.08mol:0.02mol=4:1,
故选D.
点评:本题考查氧化还原反应的计算,利用原子守恒、电子守恒是解答本题的关键,题目难度中等,注意守恒法的应用.

练习册系列答案
相关题目
向2L密闭容器中加入2molNH3和3molO2发生反应4NH3(g)+5O2(g))=4NO(g)+6H2O(g)半分钟后,测的NH3剩余1mol,下列说法不正确的是( )
| A、该反应生成了1.5mol的水蒸气 |
| B、用O2表示该反应速率为2.5mol/(L?min) |
| C、反应后容器中NO的浓度为0.5mol/L |
| D、反应后容器中n(NH3)=n(NO) |
下列各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量是定值的是( )
| A、CH2=CH2、C2H5OH、HOCH2CH2COOH |
| B、CH2O、C2H4O2、C6H12O6 |
| C、C6H6、C5H10、C6H6O |
| D、H2、CO、CH3OH |
质量分数相等的Na2CO3和NaHCO3混合物xg,加热一段时间后质量变为yg,当y为何值时,表明NaHCO3完全分解( )
A、
| ||
B、
| ||
C、
| ||
D、
|
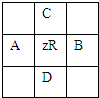 有原子序数为Z的元素R,在周期表中位于A、B、C、D四种元素中间,如图所示,
有原子序数为Z的元素R,在周期表中位于A、B、C、D四种元素中间,如图所示,A、B、C、D四种元素的原子序数之和不可能是( )
| A、4Z | B、4Z+10 |
| C、4Z+5 | D、4Z+14 |
下列实验操作中错误的是( )
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、蒸发结晶时应将溶液蒸干 |
| D、称量物质时先取小砝码,再依次取较大的砝码 |