题目内容
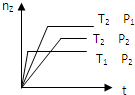 反应2X(?)+Y(g)?2Z(g)△H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
反应2X(?)+Y(g)?2Z(g)△H,在不同温度(T1>T2)及压强(P1>P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )| A、△H>0,X为气体 |
| B、△H>0,X为固体 |
| C、△H<0,X为气体 |
| D、△H<0,X为固体 |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:图示题
分析:比较T1P2线和T2P2线,T1时的nz小于T2时的,且T1>T2,所以升高温度平衡逆向移动,比较T2P1线和T2P2线,P1时的nz大于P2时的,且P1>P2,所以增大压强,平衡正向移动,据此判断.
解答:
解:比较T1P2线和T2P2线,T1时的nz小于T2时的,且T1>T2,所以升高温度平衡逆向移动,即该反应的正反应为放热反应,△H<0;比较T2P1线和T2P2线,P1时的nz大于P2时的,且P1>P2,所以增大压强,平衡正向移动,即该反应的正反应为气体体积减小的反应,所以X为气体,
故选:C.
故选:C.
点评:本题比较简单,主要考查了外界条件对化学平衡移动的影响,解题关键在于仔细观察图得出外界条件对平衡的影响.

练习册系列答案
相关题目
下列关于电解质溶液中离子浓度关系的说法正确的是( )
| A、0.1mol/L的NaHCO3溶液中离子浓度的关系:c(Na+)═c(HCO3-)+c(H2CO3)+2c(CO32-) |
| B、0.1mol/L的NH4Cl溶液和0.1mol/L的NH3?H2O等体积混合后离子浓度的关系:c(NH4+)>c( Cl-)>c(OH-)>c(H+) |
| C、常温下,物质的量浓度相等的醋酸溶液与氢氧化钠溶液等体积混合,所得溶液PH=7 |
| D、KHS溶液中存在等式关系:c(S2-)+c(OH-)=c(H+)+c(H2S) |
现有200mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol/L,c(Cl-)=1.3mol/L,要使Mg2+转化成Mg(OH)2,并使Mg2+、Al3+分离开来,4mol/L NaOH溶液的最少用量为( )
| A、140mL | B、120mL |
| C、100mL | D、80mL |
向200mL1.5mol?L-1的硫酸溶液中加入一定量Fe2O3、Cu的混合物,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,剩余固体的质量为( )
| A、17.6g | B、22.4g |
| C、2.4g | D、4.8g |
下列各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量是定值的是( )
| A、CH2=CH2、C2H5OH、HOCH2CH2COOH |
| B、CH2O、C2H4O2、C6H12O6 |
| C、C6H6、C5H10、C6H6O |
| D、H2、CO、CH3OH |
质量分数相等的Na2CO3和NaHCO3混合物xg,加热一段时间后质量变为yg,当y为何值时,表明NaHCO3完全分解( )
A、
| ||
B、
| ||
C、
| ||
D、
|