题目内容
6.4g氧气含有的氧原子的物质的量为 .
考点:物质的量的相关计算
专题:计算题
分析:结合n=
及O2的构成来计算.
| m |
| M |
解答:
解:6.4g氧气的物质的量为
=0.2mol,由O2的构成可知,氧原子的物质的量为0.2mol×2=0.4mol,
故答案为:0.4mol.
| 6.4g |
| 32g/mol |
故答案为:0.4mol.
点评:本题考查物质的量的计算,为高频考点,把握物质的量的有关计算公式及分子构成为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
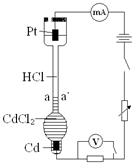 设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu).恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa′处形成清晰的界面.通电后,可观察到清晰界面缓缓向上移动.下列说法正确的是( )
设计如下装置探究HCl溶液中阴、阳离子在电场中的相对迁移速率(已知:Cd的金属活动性大于Cu).恒温下,在垂直的玻璃细管内,先放CdCl2溶液及显色剂,然后小心放入HCl溶液,在aa′处形成清晰的界面.通电后,可观察到清晰界面缓缓向上移动.下列说法正确的是( )| A、通电时,H+、Cd2+向Cd电极迁移,Cl-向Pt电极迁移 | ||||
| B、一定时间内,如果通过HCl溶液某一界面的总电量为1.0 C,测得H+所迁移的电量为0.82 C,说明该HCl溶液中H+的迁移速率约是Cl-的4.6倍 | ||||
| C、如果电源正负极反接,则下端产生大量Cl2,使界面不再清晰,实验失败 | ||||
D、装置中总反应的化学方程式为:2HCl
|
向2L密闭容器中加入2molNH3和3molO2发生反应4NH3(g)+5O2(g))=4NO(g)+6H2O(g)半分钟后,测的NH3剩余1mol,下列说法不正确的是( )
| A、该反应生成了1.5mol的水蒸气 |
| B、用O2表示该反应速率为2.5mol/(L?min) |
| C、反应后容器中NO的浓度为0.5mol/L |
| D、反应后容器中n(NH3)=n(NO) |
现有200mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol/L,c(Cl-)=1.3mol/L,要使Mg2+转化成Mg(OH)2,并使Mg2+、Al3+分离开来,4mol/L NaOH溶液的最少用量为( )
| A、140mL | B、120mL |
| C、100mL | D、80mL |
向200mL1.5mol?L-1的硫酸溶液中加入一定量Fe2O3、Cu的混合物,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,剩余固体的质量为( )
| A、17.6g | B、22.4g |
| C、2.4g | D、4.8g |
下列各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量是定值的是( )
| A、CH2=CH2、C2H5OH、HOCH2CH2COOH |
| B、CH2O、C2H4O2、C6H12O6 |
| C、C6H6、C5H10、C6H6O |
| D、H2、CO、CH3OH |
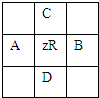 有原子序数为Z的元素R,在周期表中位于A、B、C、D四种元素中间,如图所示,
有原子序数为Z的元素R,在周期表中位于A、B、C、D四种元素中间,如图所示,A、B、C、D四种元素的原子序数之和不可能是( )
| A、4Z | B、4Z+10 |
| C、4Z+5 | D、4Z+14 |