题目内容
16.已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:醋酸 K=1.75×10-5
碳酸 K1=4.30×10 -7 K2=5.61×10 -11
亚硫酸 K1=1.54×10-2 K2=1.02×10 -7
(1)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性由强到弱的顺序:H2CO3>HSO3->HCO3-.
(2)若保持温度不变,在醋酸溶液中加入少量HCl,下列量会变小的是AD(填序号)
A.c(CH3COO-)B.c(H+)C.醋酸的电离平衡常数D.醋酸的电离度
(3)某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如表:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-23 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)25℃时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如表.
| 实验编号 | 起始浓度/mol/L | 反应后溶液的pH | |
| c (HA) | c (NaOH) | ||
| ① | 0.10 | 0.10 | 9 |
| ② | X | 0.05 | 7 |
分析 (1)根据H2CO3、HCO3-和HSO3-的电离平衡常数确定酸性的强弱;
(2)因加入盐酸,醋酸的电离平衡逆向移动,则c(CH3COO-)减小,醋酸的电离程度减小,但温度不变,则醋酸电离平衡常数不变,加盐酸时c(H+)增大;
(3)由表格中的数据可知,溶度积越小的越易转化为沉淀;
(4)HA与NaOH恰好反应生成NaA时,溶液显碱性,说明HA为弱酸;根据物料守恒分析.
解答 解:(1)H2CO3、HCO3-和HSO3-的电离平衡常数分别是:4.30×10-7、5.61×10-11、1.02×10-7,所以酸性顺序是:H2CO3>HSO3->HCO3-,
故答案为:H2CO3>HSO3->HCO3-;
(2)因加入盐酸,醋酸的电离平衡逆向移动,则c(CH3COO-)减小,醋酸的电离程度减小,但温度不变,则醋酸电离平衡常数和水的离子积常数不变,加盐酸时c(H+)增大,
故答案为:AD;
(3)由表格中的数据可知,溶度积越小的越易转化为沉淀,显然只有硫化物的溶度积小,则应选择硫化钠,
故答案为:B;
(4)由实验①可知,HA与NaOH恰好反应生成NaA时,溶液显碱性,说明HA为弱酸,若要混合显中性,则HA要稍微过量,所以X大于0.05;实验①中溶液的溶质为NaA,由物料守恒可知,c(A-)+c(HA)=0.05 mol•L-1;
故答案为:大于;0.05 mol•L-1.
点评 本题考查了盐类水解、弱酸的电离平衡常数与酸性强弱的关系、弱酸的电离平衡的移动、沉淀的转化,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列除去杂质的方法正确的是( )
| 物质(括号内为杂质) | 试剂 | |
| A | CO2(SO2) | Na2CO3溶液 |
| B | FeCl3溶液(CuCl2) | Fe |
| C | Fe2O3(Al2O3) | NaOH溶液 |
| D | Na2SO4溶液(Na2CO3) | 盐酸 |
| A. | A | B. | B | C. | C | D. | D |
7.下列关于有机化合物的说法正确的是( )
| A. | 2-甲基丁烷也称异丁烷 | |
| B. | 由乙烯生成乙醇属于加成反应 | |
| C. | C4H9Cl有3种同分异构体 | |
| D. | 光照条件下,甲烷通入氯水中,氯水黄绿色褪去,说明甲烷与氯水发生了取代反应 |
4.下列实验装置、操作能达到实验目的是( )
| A. |  测定中和热 | B. |  沉淀转化 | ||
| C. |  粗铜的电解精炼 | D. |  电解食盐水 |
11.下列说法中正确的是( )
| A. | CuCl2溶液蒸干灼烧后得到CuCl2固体 | |
| B. | 火力发电的目的是使化学能转换为电能 | |
| C. | 已知C(石墨,s)=C(金刚石,s)△H>0,无法比较二者的稳定性. | |
| D. | 将FeCl3固体溶于适量蒸馏水来配制FeCl3溶液 |
1.下列离子方程式书写正确的是( )
| A. | H2SO4与 Ba(OH)2 溶液反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 金属钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 向足量NaHCO3溶液中滴人少量Ca(OH)2溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| D. | 常温下,将氯气通人水中:Cl2+H2O═2H++2Cl-+ClO- |
8.下列实验操作中正确的是( )
| A. | 将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 | |
| B. | 分液操作时,静置分层后要先放出分液漏斗中下层液体,再倒出上层液体 | |
| C. | 分液操作时,选择的萃取剂的密度必须比水大 | |
| D. | 用胶头滴管向试管滴加液体时,滴管尖端靠在试管内壁 |
19.已知某饱和溶液的①溶液质量,②溶剂质量,③溶液体积,④溶质的摩尔质量,⑤溶质的溶解度,⑥溶液的密度.利用以上部分已知条件不能计算出该饱和溶液的物质的量的浓度的是( )
| A. | ①②④⑥ | B. | ②④⑤ | C. | ①②③④ | D. | ④⑤⑥ |
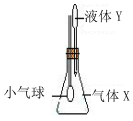 在如图所示示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y可能是( )
在如图所示示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y可能是( )