题目内容
7.下列关于有机化合物的说法正确的是( )| A. | 2-甲基丁烷也称异丁烷 | |
| B. | 由乙烯生成乙醇属于加成反应 | |
| C. | C4H9Cl有3种同分异构体 | |
| D. | 光照条件下,甲烷通入氯水中,氯水黄绿色褪去,说明甲烷与氯水发生了取代反应 |
分析 A.2-甲基丁烷含5个C;
B.由乙烯生成乙醇,碳碳双键转化为单键;
C.丁基有4种;
D.甲烷通入氯水,不反应.
解答 解:A.2-甲基丁烷含5个C,则2-甲基丁烷也称异戊烷,故A错误;
B.由乙烯生成乙醇,碳碳双键转化为单键,则为加成反应,故B正确;
C.丁基有4种,则C4H9Cl有4种同分异构体,故C错误;
D.甲烷通入氯水,不反应,光照下甲烷与氯气发生取代反应,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机反应的判断,题目难度不大.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案
相关题目
18.下列有关化学用语表示正确的是( )
| A. | 乙酸的结构简式:C2H4O2 | |
| B. | S2-的结构示意图: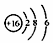 | |
| C. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | CO2的电子式 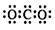 |
15.在密闭容中发生下列反应aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.9倍,下列叙述正确的是( )
| A. | a>c+d | B. | 平衡向正反应方向移动 | ||
| C. | D的体积分数变大 | D. | A的转化率变小 |
12.人类社会的发展离不开科学家的贡献,下列说法中正确的是( )
| A. | 汤姆生--提出带核的原子结构模型 | |
| B. | 维勒--合成尿素实现了无机物向有机物的转化 | |
| C. | 玻尔--根据ɑ粒子散射现象提出原子结构的量子力学模型 | |
| D. | 侯德榜--侯氏制碱法的原理是将氨气通入二氧化碳的氯化钠饱和溶液中 |
19.下列关于2mol氧气的叙述中,正确的是( )
| A. | 质量是32 g | B. | 体积是44.8 L | ||
| C. | 分子数是1.204×1024 | D. | 原子数是2 mol |
16.已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸 K=1.75×10-5
碳酸 K1=4.30×10 -7 K2=5.61×10 -11
亚硫酸 K1=1.54×10-2 K2=1.02×10 -7
(1)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性由强到弱的顺序:H2CO3>HSO3->HCO3-.
(2)若保持温度不变,在醋酸溶液中加入少量HCl,下列量会变小的是AD(填序号)
A.c(CH3COO-)B.c(H+)C.醋酸的电离平衡常数D.醋酸的电离度
(3)某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如表:
你认为往废水中投入B沉淀效果最好(填字母)
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)25℃时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如表.
则表中X大于0.05(填“大于”“等于”、“小于”);实验①所得溶液中c(A-)+c(HA)=0.05 mol•L-1.
醋酸 K=1.75×10-5
碳酸 K1=4.30×10 -7 K2=5.61×10 -11
亚硫酸 K1=1.54×10-2 K2=1.02×10 -7
(1)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性由强到弱的顺序:H2CO3>HSO3->HCO3-.
(2)若保持温度不变,在醋酸溶液中加入少量HCl,下列量会变小的是AD(填序号)
A.c(CH3COO-)B.c(H+)C.醋酸的电离平衡常数D.醋酸的电离度
(3)某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如表:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-23 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)25℃时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如表.
| 实验编号 | 起始浓度/mol/L | 反应后溶液的pH | |
| c (HA) | c (NaOH) | ||
| ① | 0.10 | 0.10 | 9 |
| ② | X | 0.05 | 7 |
10.一定物质的量浓度溶液的配制是中学化学中为数不多的定量实验之一,同学们在学习时一定要重视.配制100mL 1.0mol•L-1的NaOH溶液,下列情况会导致溶液浓度偏高的是( )
| A. | 容量瓶使用前经蒸馏水清洗后没有干燥 | |
| B. | 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 | |
| C. | 俯视确定凹液面与刻度线相切 | |
| D. | 用敞口容器称量NaOH且时间过长 |
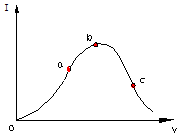 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答: