题目内容
5.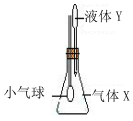 在如图所示示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y可能是( )
在如图所示示装置中,将液体Y滴入瓶中并摇动,一会儿小气球胀大.则气体X与液体Y可能是( )| A | B | C | D | |
| 气体X | NH3 | SO2 | CO2 | HCl |
| 液体Y | 稀硫酸 | 浓NaOH | 饱和NaHCO3 | 水 |
| A. | A | B. | B | C. | C | D. | D |
分析 将液体Y滴入瓶中并摇动,一会儿小气球胀大,则气体X与液体Y发生反应,或气体极易溶于水,导致锥形瓶中气体减少,则外压大于内压,以此来解答.
解答 解:A.氨气与稀硫酸反应,气体减少,符合,故A不选;
B.二氧化硫与NaOH反应生成亚硫酸钠和水,气体减少,符合,故B不选;
C.碳酸氢钠溶液抑制二氧化碳的溶解,则气体不能减少,不符合,故C选;
D.HCl极易溶于水,气体减小,符合,故D不选;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、气体的性质及反应为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.在密闭容中发生下列反应aA(g)?cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.9倍,下列叙述正确的是( )
| A. | a>c+d | B. | 平衡向正反应方向移动 | ||
| C. | D的体积分数变大 | D. | A的转化率变小 |
16.已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸 K=1.75×10-5
碳酸 K1=4.30×10 -7 K2=5.61×10 -11
亚硫酸 K1=1.54×10-2 K2=1.02×10 -7
(1)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性由强到弱的顺序:H2CO3>HSO3->HCO3-.
(2)若保持温度不变,在醋酸溶液中加入少量HCl,下列量会变小的是AD(填序号)
A.c(CH3COO-)B.c(H+)C.醋酸的电离平衡常数D.醋酸的电离度
(3)某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如表:
你认为往废水中投入B沉淀效果最好(填字母)
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)25℃时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如表.
则表中X大于0.05(填“大于”“等于”、“小于”);实验①所得溶液中c(A-)+c(HA)=0.05 mol•L-1.
醋酸 K=1.75×10-5
碳酸 K1=4.30×10 -7 K2=5.61×10 -11
亚硫酸 K1=1.54×10-2 K2=1.02×10 -7
(1)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性由强到弱的顺序:H2CO3>HSO3->HCO3-.
(2)若保持温度不变,在醋酸溶液中加入少量HCl,下列量会变小的是AD(填序号)
A.c(CH3COO-)B.c(H+)C.醋酸的电离平衡常数D.醋酸的电离度
(3)某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol/L.排放前拟用沉淀法除去这两种离子,查找有关数据如表:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-23 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)25℃时,将某一元酸HA和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如表.
| 实验编号 | 起始浓度/mol/L | 反应后溶液的pH | |
| c (HA) | c (NaOH) | ||
| ① | 0.10 | 0.10 | 9 |
| ② | X | 0.05 | 7 |
13.下列实验装置或操作正确且能达到实验目的是( )
| A. | 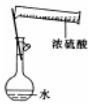 配制一定物质的量浓度的稀硫酸 | B. | 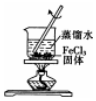 制取少量的Fe(OH)3胶体 | ||
| C. | 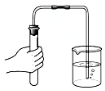 检查气密性 | D. | 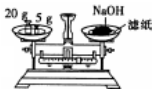 称量NaOH固体 |
3.四种短周期元素X、Y、Z、W,已知X、Y的阳离子a Xn+、b Y(n+1)+电子层结构与Z、W的阴离子c Zm-、d W(m+1)-电子层结构相同.下列叙述正确的是( )
| A. | 最高价氧化物对应水化物的碱性大小顺序一定是:X>Y | |
| B. | 离子半径和原子半径由大到小的顺序均为X>Y>Z>W | |
| C. | 氢化物的稳定性是Z<W | |
| D. | 还原性Z m->W(m+1)-,氧化性Xn+>Y(n+1)+ |
10.一定物质的量浓度溶液的配制是中学化学中为数不多的定量实验之一,同学们在学习时一定要重视.配制100mL 1.0mol•L-1的NaOH溶液,下列情况会导致溶液浓度偏高的是( )
| A. | 容量瓶使用前经蒸馏水清洗后没有干燥 | |
| B. | 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 | |
| C. | 俯视确定凹液面与刻度线相切 | |
| D. | 用敞口容器称量NaOH且时间过长 |
8.除去氯化钠溶液中少量的碘,常用的方法是( )
| A. | 蒸发 | B. | 升华 | C. | 结晶 | D. | 萃取 |