题目内容
钼是一种过渡金属元素,通常用作合 金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能.如图是化工生产中制备金属钼的实验流程图:
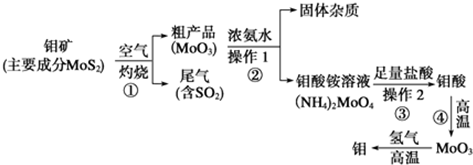
(1)钼酸铵溶液中阳离子的检验方法: .
(2)写出反应①的化学方程式: .
(3)反应①的尾气可以用NH3?H2O溶液吸收用于合成肥料,写出反应的离子方程式 .
(4)工厂排放的废水中,金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+.处理时首先在酸性条件下用H2O2将Cr3+转化为Cr2O72-,再用NaOH调节溶液的pH到8,然后用钠离子交换树脂除去Ca2+和Mg2+,最后通入SO2 生成CrOH(H2O)5SO4沉淀.
①H2O2的作用是将溶液中的Cr3+转化为Cr2O72-,写出此反应的离子方程式: .
②常温下,部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下:
加入NaO H溶液使溶液呈碱性,Cr2O72-转化为CrO42-.但溶液的pH不能超过8,此时产生的沉淀是 .
③写出上述过程中用SO2作还原剂进行还原的离子方程式 .

(1)钼酸铵溶液中阳离子的检验方法:
(2)写出反应①的化学方程式:
(3)反应①的尾气可以用NH3?H2O溶液吸收用于合成肥料,写出反应的离子方程式
(4)工厂排放的废水中,金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+.处理时首先在酸性条件下用H2O2将Cr3+转化为Cr2O72-,再用NaOH调节溶液的pH到8,然后用钠离子交换树脂除去Ca2+和Mg2+,最后通入SO2 生成CrOH(H2O)5SO4沉淀.
①H2O2的作用是将溶液中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:
②常温下,部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | - | - | - |
| 完全沉淀时的pH | 3.7 | 11.1 | 8(>9溶解) | 9 |
③写出上述过程中用SO2作还原剂进行还原的离子方程式
考点:金属的回收与环境、资源保护
专题:实验设计题
分析:(1)根据中学所学检验铵离子的方法完成;
(2)在空气中灼烧生成三氧化钼和二氧化硫;
(3)二氧化硫与氨水反应生成亚硫酸铵的离子方程式;
(4)①根据双氧水的性质分析,双氧水有强氧化性,能氧化还原性的物质,依据氧化还原反应电子守恒、原子守恒配平书写离子方程式;
②硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+.加入过氧化氢氧化铬离子为Cr2O72-,加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-.
溶液PH=8,Fe3+、Al3+沉淀完全;
③依据流程图中的转化关系和产物,结合二氧化硫的还原性,利用氧化还原反应原理分析书写.
(2)在空气中灼烧生成三氧化钼和二氧化硫;
(3)二氧化硫与氨水反应生成亚硫酸铵的离子方程式;
(4)①根据双氧水的性质分析,双氧水有强氧化性,能氧化还原性的物质,依据氧化还原反应电子守恒、原子守恒配平书写离子方程式;
②硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+.加入过氧化氢氧化铬离子为Cr2O72-,加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-.
溶液PH=8,Fe3+、Al3+沉淀完全;
③依据流程图中的转化关系和产物,结合二氧化硫的还原性,利用氧化还原反应原理分析书写.
解答:
解:(1)氨气能够使湿润的紫色的石蕊试纸变蓝,利用此性质进行检验铵离子,所以检验方法是:取少量钼酸铵溶液于试管中,加入NaOH加热,在试管口放一张润湿的紫色石蕊试纸,若试纸变蓝,则证明钼酸铵溶液中含有铵根离子,
故答案为:取少量钼酸铵溶液于试管中,加入NaOH加热,在试管口放一张润湿的紫色石蕊试纸,若试纸变蓝,则证明钼酸铵溶液中含有铵根离子;
(2)二硫化钼在空气灼烧生成了三氧化钼和二氧化硫,反应的化学方程式为:2MoS2+702
2Mo03+4S02,故答案为:2MoS2+702
2Mo03+4S02;
(3)二氧化硫与氨水反应生成了亚硫酸铵,离子方程式为:2NH3?H2O+SO2═2NH4++SO32-+2H2O,故答案为:2NH3?H2O+SO2═2NH4++SO32-+H2O
(4)①双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离,
故答案为:2Cr3++3H2O2+H2O=Cr2O72-+8H+;
②硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+.加入过氧化氢氧化铬离子为Cr2O72-,加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-.
溶液PH=8,Fe3+、Al3+沉淀完全,则此时产生的沉淀是Fe(OH)3、Al(OH)3;
故答案为:Fe(OH)3、Al(OH)3;
③二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为硫酸,Na2CrO4氧被还原为CrOH(H2O)5SO4,水溶液中生成氢氧化钠溶液和硫酸反应生成硫酸钠,依据原子守恒分析书写配平;3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH,则其离子方程式为:3SO2+2CrO42-+12H2O═2CrOH(H2O)5SO4↓+SO42-+2OH-;
故答案为:3SO2+2CrO42-+12H2O═2CrOH(H2O)5SO4↓+SO42-+2OH-.
故答案为:取少量钼酸铵溶液于试管中,加入NaOH加热,在试管口放一张润湿的紫色石蕊试纸,若试纸变蓝,则证明钼酸铵溶液中含有铵根离子;
(2)二硫化钼在空气灼烧生成了三氧化钼和二氧化硫,反应的化学方程式为:2MoS2+702
| ||
| ||
(3)二氧化硫与氨水反应生成了亚硫酸铵,离子方程式为:2NH3?H2O+SO2═2NH4++SO32-+2H2O,故答案为:2NH3?H2O+SO2═2NH4++SO32-+H2O
(4)①双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离,
故答案为:2Cr3++3H2O2+H2O=Cr2O72-+8H+;
②硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+.加入过氧化氢氧化铬离子为Cr2O72-,加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-.
溶液PH=8,Fe3+、Al3+沉淀完全,则此时产生的沉淀是Fe(OH)3、Al(OH)3;
故答案为:Fe(OH)3、Al(OH)3;
③二氧化硫具有还原性,被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为硫酸,Na2CrO4氧被还原为CrOH(H2O)5SO4,水溶液中生成氢氧化钠溶液和硫酸反应生成硫酸钠,依据原子守恒分析书写配平;3SO2+2Na2CrO4+12H2O=2CrOH(H2O)5SO4↓+Na2SO4+2NaOH,则其离子方程式为:3SO2+2CrO42-+12H2O═2CrOH(H2O)5SO4↓+SO42-+2OH-;
故答案为:3SO2+2CrO42-+12H2O═2CrOH(H2O)5SO4↓+SO42-+2OH-.
点评:本题考查了离子方程式、化学方程式的书写、物质的分离等知识点,难度较大,注意会运用溶液的PH值对溶液中的离子进行分离,除杂的原则是:除去杂质且不引进新的杂质.

练习册系列答案
相关题目
下列关于金属的描述不正确的是( )
| A、地壳中含量最多的金属元素是Al |
| B、金属一般是热和电的良导体 |
| C、自然界中绝大多数金属元素以游离态的形式存在 |
| D、金属一般呈银白色具有金属光泽 |
已知,某元素的质量数为288,它的原子核内有169个中子,该元素的原子序数为( )
| A、169 | B、457 |
| C、288 | D、119 |
 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( )  研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.