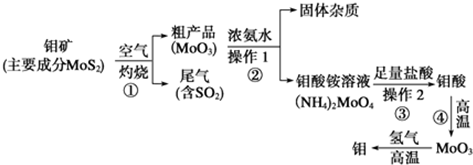
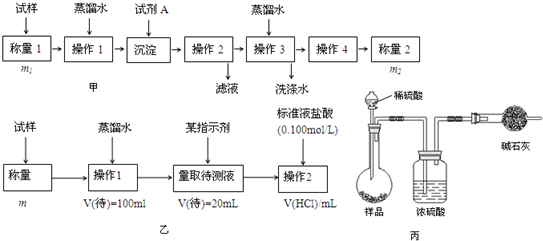
题目内容
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.(1)NO2可用强碱溶液吸收,反应的离子方程式为
利用反应:6NO2+8NH3
| 催化剂 |
| 加热 |
(2)已知:①.2SO2(g)+O2(g)═2SO3(g);△H=-196.6kJ?mol-1
②.2NO(g)+O2(g)═2NO2(g);△H=-113.0kJ?mol-1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H=
(3)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列叙述能说明该反应达到平衡状态的是
a.体系压强保持不变 b.混合气体颜色保持不变c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1molNO2测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=
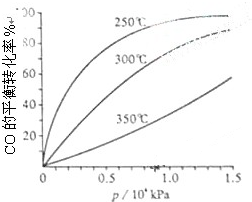
(4)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)═CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图所示.该反应△H
考点:热化学方程式,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)NaOH溶液吸收NO2,生成两种盐,分别为硝酸盐和亚硝酸盐,据此写出离子方程式;根据化合价的变化结合方程式计算;
(2)利用盖斯定律计算反应热;平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,计算平衡时各物质的浓度,可计算平衡常数.
(3)从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动.
(2)利用盖斯定律计算反应热;平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,计算平衡时各物质的浓度,可计算平衡常数.
(3)从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动.
解答:
解:(1)NaOH溶液吸收NO2,生成两种盐,分别为硝酸盐和亚硝酸盐,离子方程式为:2NO2+2OH-=NO2-+NO3-+H2O;反应6NO2+8NH3
7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6molNO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗NO20.3mol,体积为6.72L;
故答案为:2NO2+2OH-=NO2-+NO3-+H2O;6.72;
(2)已知:①2SO2(g)+O2(g)═2SO3(g);△H=-196.6kJ?mol-1
②2NO(g)+O2(g)═2NO2(g);△H=-113.0kJ?mol-1
利用盖斯定律将①×
-②×
得:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=
×(-196.6kJ?mol-1)-
×(-113.0kJ?mol-1)=-41.8kJ?mol-1,
故答案为:-41.8;
(3)a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故a错误;
b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;
c.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故c错误;
d.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,故d错误.
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即(1a-x):(2a-x)=1:6,故x=
a,故平衡常数K=
=
=
;
故答案为:b;
;
(4)从横坐标上一点0.5处,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越高转化率越低,说明,升温时平衡向逆向移动,反应热小于0;
实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,压强越大需要的条件越高,花费越大,
故答案为:<;在1.3×104kPa下,CO的转化率已经很高,如果增大压强CO的转化率提高不大,而生产成本将大大增加.
| 催化剂 |
| 加热 |
故答案为:2NO2+2OH-=NO2-+NO3-+H2O;6.72;
(2)已知:①2SO2(g)+O2(g)═2SO3(g);△H=-196.6kJ?mol-1
②2NO(g)+O2(g)═2NO2(g);△H=-113.0kJ?mol-1
利用盖斯定律将①×
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:-41.8;
(3)a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故a错误;
b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;
c.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故c错误;
d.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,故d错误.
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即(1a-x):(2a-x)=1:6,故x=
| 4 |
| 5 |
| C(SO3)C(NO) |
| c(NO2)C(SO2) |
| ||||
|
| 8 |
| 3 |
故答案为:b;
| 8 |
| 3 |
(4)从横坐标上一点0.5处,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越高转化率越低,说明,升温时平衡向逆向移动,反应热小于0;
实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,压强越大需要的条件越高,花费越大,
故答案为:<;在1.3×104kPa下,CO的转化率已经很高,如果增大压强CO的转化率提高不大,而生产成本将大大增加.
点评:本题以NO2、SO2、CO等物质为载体,综合考查化学平衡移动、盖斯定律以及平衡常数的计算等问题,侧重于学生综合运用化学知识的能力的考查,题目难度中等.

练习册系列答案
相关题目
铁是目前使用量最大的金属,下列有关铁及其化合物的说法正确的是( )
| A、铁是位于第四周期第ⅧB族的元素,是一种重要的过渡元素 |
| B、向浅绿色的Fe(NO3)2溶液中加入盐酸,溶液变黄 |
| C、14 g铁粉和7 g硫粉在空气中充分反应能生成21 g 硫化亚铁 |
| D、四氧化三铁可以看成是氧化铁和氧化亚铁组成的混合物 |
将6mol A和5mol B混合于2L恒容密闭容器中,发生如下反应:3A(g)+B(g)?nC(g)+2D(g),5s后反应达到平衡状态,生成2mol D,经测定以C表示的平均反应速率为0.4mol?L-1?s-1.则下列结论中正确的是( )
| A、5 s内以A表示的平均反应速率为0.15 mol?L-1?s-1 |
| B、n值等于4 |
| C、平衡时B的转化率为20% |
| D、平衡时,B的浓度为4mol?L-1 |
苹果酸的结构简式为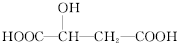 ,下列说法正确的是( )
,下列说法正确的是( )
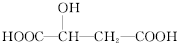 ,下列说法正确的是( )
,下列说法正确的是( )A、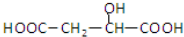 与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
| B、1 mol苹果酸可与3 mol NaOH发生中和反应 |
| C、1 mol苹果酸与足量金属Na反应生成1 mol H2 |
| D、四联苯的一氯代物有5种 |
为了有效除去工业食盐中的Ca2+、Mg2+、SO42-,加入试剂的合理顺序为( )
| A、先加NaOH,后加Na2CO3,再加BaCl2 |
| B、先加NaOH,后加BaCl2,再加Na2CO3 |
| C、先加BaCl2,后加NaOH,再加Na2CO3 |
| D、先加Na2CO3,后加BaCl2溶液,再加NaOH |