题目内容
19.X、Y、Z、E、T均为短周期元素,在周期表中的相对位置如图1.X是短周期中原子半径最大的元素; X、Y在同一周期,Y是常见的半导体材料; E的最高价氧化物对应水化物有强脱水性.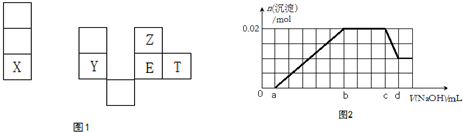
根据判断出的元素回答问题:
(1)T在元素周期表中的位置第三周期,第ⅦA族;
(2)这几种元素的氢化物中,水溶液酸性最强的是HCl(填化学式);YZ2的熔点高于EZ2的熔点(填高于或低于);
(3)E2T2的电子式
 ;
;(4)工业上制备单质X的化学反应方程式2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑;
(5)已知1mol晶体Y在足量Z2中燃烧,恢复至室温,放出989.2kJ 热量,写出该反应的热化学方程式:Si(s)+O2(g)═SiO2(s)△H=-989.2kJ•mol-1;
(6)某溶液中可能含有以下阳离子(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Al3+,现取100mL该溶液逐滴滴加NaOH溶液,测得沉淀的物质的量与NaOH溶液的体积关系如图2所示.
①在实验中,NaOH溶液滴至b~c段过程中发生的离子反应方程式为NH4++OH-=NH3•H2O;NaOH溶液的浓度为$\frac{10}{d-c}$ mol•L-1 (用字母c、d表示);
②原溶液中含有的Mg2+、Al3+、H+,其物质的量之比n(Mg2+):n(Al3+):n(H+)为1:1:1.
分析 X是短周期中原子半径最大的元素是钠元素; X、Y在同一周期,Y是常见的半导体材料所以Y是硅元素; E的最高价氧化物对应水化物有强脱水性,所以E是硫元素,则T是氯元素,Z是氧元素;
(1)氯元素三个电子层,最外层7个电子;
(2)这几种元素的氢化物中,水溶液酸性最强的是盐酸,SiO2是原子晶体,而二氧化硫是分子晶体,二氧化硅熔点高于SO2的熔点;
(3)E2T2的化学式为:S2Cl2,电子式为: ;
;
(4)工业上是电解熔融的氯化钠制备单质钠的;
(5)已知1mol晶体硅在足量氧气中燃烧,恢复至室温,放出989.2kJ 热量,所以热化学方程式为:Si(s)+O2(g)═SiO2(s)△H=-989.2 kJ•mol-1;
(6)①通过图象知,在加入过量的过氧化钠的过程中,一开始就有沉淀生成,说明不含有H+,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3•H2O,最后溶液中有沉淀,说明溶液中含Mg2+;原溶液确定含有Mg2+、Al3+、NH4+,由图可知,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2]+n[Al(OH)3]=0.02mol,沉淀最小时,为氢氧化镁,故n[Mg(OH)2]=0.01mol,故n[Al(OH)3]=0.02mol-0.01mol=0.01mol,根据铝元素守恒可知n(Al3+)=n[Al(OH)3]=0.01mol,根据Al(OH)3+OH-=AlO2-+2H2O,需OH-0.01mol;由图可知消耗Na0H(d-c)mL,所以c(Na0H )=$\frac{n}{V}$,由此分析解答;
②原溶液确定含有Mg2+、Al3+、NH4+,由图可知,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2]+n[Al(OH)3]=0.02mol,沉淀最小时,为氢氧化镁,故n[Mg(OH)2]=0.01mol,故n[Al(OH)3]=0.02mol-0.01mol=0.01mol,根据铝元素守恒可知n(Al3+)=n[Al(OH)3]=0.01mol,根据Al3++3OH-=Al(OH)3↓,需OH-0.03mol;根据镁元素守恒可知原溶液中n(Mg2+)=n[Mg(OH)2]=0.01mol,由(2)知而c到d一格氢氧根离子的浓度为0.01mol,0→a与氢离子反应,所以氢离子的物质的量为0.01mol,由此求原溶液确定含有Mg2+、Al3+、H+,其物质的量之比.
解答 解:X是短周期中原子半径最大的元素是钠元素; X、Y在同一周期,Y是常见的半导体材料所以Y是硅元素; E的最高价氧化物对应水化物有强脱水性,所以E是硫元素,则T是氯元素,Z是氧元素;
(1)氯元素三个电子层,最外层7个电子,所以T在元素周期表中的位置是第三周期,第ⅦA族,故答案为:第三周期,第ⅦA族;
(2)这几种元素的氢化物中,水溶液酸性最强的是盐酸,SiO2是原子晶体,而二氧化硫是分子晶体,二氧化硅熔点高于SO2的熔点,故答案为:HCl;高于;
(3)E2T2的化学式为:S2Cl2,电子式为: ,故答案为:
,故答案为: ;
;
(4)工业上是电解熔融的氯化钠制备单质钠的,化学反应方程式2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,故答案为:2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑;
(5)已知1mol晶体硅在足量氧气中燃烧,恢复至室温,放出989.2kJ 热量,所以热化学方程式为:Si(s)+O2(g)═SiO2(s)△H=-989.2 kJ•mol-1,故答案为:Si(s)+O2(g)═SiO2(s)△H=-989.2 kJ•mol-1;
(6)①通过图象知,在加入过量的过氧化钠的过程中,一开始就有沉淀生成,说明不含有H+,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3•H2O,最后溶液中有沉淀,说明溶液中含Mg2+,所以NaOH溶液滴至b~c段过程中发生的离子反应方程式为NH4++OH-=NH3•H2O,原溶液确定含有Mg2+、Al3+、NH4+,由图可知,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2]+n[Al(OH)3]=0.02mol,沉淀最小时,为氢氧化镁,故n[Mg(OH)2]=0.01mol,故n[Al(OH)3]=0.02mol-0.01mol=0.01mol,根据铝元素守恒可知n(Al3+)=n[Al(OH)3]=0.01mol,根据Al(OH)3+OH-=AlO2-+2H2O,需OH-0.01mol;由图可知消耗Na0H(d-c)mL,所以c(Na0H )=$\frac{n}{V}$=$\frac{0.01}{(d-c)×0.001}$=$\frac{10}{d-c}$mol•L-1,故答案为:NH4++OH-=NH3•H2O;$\frac{10}{d-c}$ mol•L-1;
②原溶液确定含有Mg2+、Al3+、NH4+,由图可知,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2]+n[Al(OH)3]=0.02mol,沉淀最小时,为氢氧化镁,故n[Mg(OH)2]=0.01mol,故n[Al(OH)3]=0.02mol-0.01mol=0.01mol,根据铝元素守恒可知n(Al3+)=n[Al(OH)3]=0.01mol,根据Al3++3OH-=Al(OH)3↓,需OH-0.03mol;根据镁元素守恒可知原溶液中n(Mg2+)=n[Mg(OH)2]=0.01mol,由(2)知而c到d一格氢氧根离子的浓度为0.01mol,0→a与氢离子反应,所以氢离子的物质的量为0.01mol,则n(Mg2+):n(Al3+):n(H+)为1:1:1,故答案为:1:1:1.
点评 本题考查结构性质位置关系、常用化学用语、元素化合物性质等,推断元素是解题,定性分析离子共存、定量分析离子的物质的量是解题的关键,注意基础知识的理解掌,题目难度中等.

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案| A. | 单质的还原性:W>X>Y | |
| B. | 原子半径:X>Y>Z>W | |
| C. | X的最高价氧化物对应水化物的碱性比Y的弱 | |
| D. | 化合物XYW4具有强氧化性 |
①元素对应的原子半径大小为:X<Z<Y<M<W;
②Y是组成有机物的必要元素
③Z与X可形成两种常见的共价化合物,与W可形成两种常见的离子化合物;
④M的电子层数与最外层电子数相等.
下列说法不正确的是( )
| A. | W、M的离子半径及最高价氧化物对应水化物的碱性皆为M<W | |
| B. | YZ2为直线型的共价化合物,W2Z2既含有离子键又含有共价键 | |
| C. | Y与X形成的化合物的熔沸点一定低于Z与X形成的化合物的熔沸点 | |
| D. | Z与M形成的化合物可作为耐高温材料,W、M、X以1:1:4组成的化合物是应用前景很广泛的储氢材料,具有很强的还原性 |
| A. | K+、CO32-、NO3-、Cl- | B. | Na+,NH4+、Cl-,SO42- | ||
| C. | NH4+、K+、HCO3-、Cl- | D. | Na+、Ba2+、Br-、Cl- |
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 定容时观察液面俯视 | |
| C. | 滴管加水时,有少量水滴到容量瓶外 | |
| D. | 溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
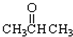 ③CH3CH2Br ④
③CH3CH2Br ④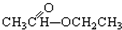 ⑤
⑤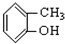 ⑥
⑥ ⑦
⑦ ⑧
⑧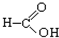 ⑨
⑨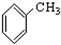 ⑩
⑩
 .
.