题目内容
17.下列说法正确的是( )| A. | 氯气与明矾处理水的原理完全相同 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 植物通过光合作用将二氧化碳转化为糖是太阳能转变成热能的过程 | |
| D. | 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 |
分析 A.氯水中HClO具有强氧化性,明矾中铝离子水解生成胶体;
B.海水中得到NaCl蒸发即可;
C.植物通过光合作用将二氧化碳转化为糖,为太阳能转化为化学能;
D.铝制品表面的氧化膜为致密的结构.
解答 解:A.氯水中HClO具有强氧化性,明矾中铝离子水解生成胶体,则净化水的原理不同,故A错误;
B.海水中得到NaCl蒸发即可,为物理变化,故B错误;
C.植物通过光合作用将二氧化碳转化为糖,为太阳能转化为化学能,故C错误;
D.铝制品表面的氧化膜为致密的结构,则铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀,故D正确;
故选D.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
12.新切开的苹果在空气中放置一段时间表面会变黄,最终变成褐色,这种现象在食品科学上通常称为“褐变”. 关于苹果褐变的原因有以下两种说法:
A.苹果中的Fe2+被空气中的氧气氧化成了Fe3+
B.苹果中的酚类物质被空气中的氧气氧化了
究竟哪种说法正确,某小组同学通过实验进行了探究.
实验用品:苹果、浓度均为0.1mol•L-1的盐酸、NaHCO3溶液、Na2SO3溶液,KSCN溶液,去氧蒸馏水.
(1)探究1:
(2)探究2:
【查阅文献】
苹果中含有多种酚和酚氧化酶,苹果中酚氧化酶的活性温度为35℃左右、活性pH约为5.5-7.5.
Ⅱ.酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色,如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色.
该小组将刚削皮的苹果切成七块,分别进行如下实验.请填写下表中相应的结论:
(3)问题分析:
Ⅰ、常温下,浓度均为0.1mol•L -1 NaHCO3溶液略显碱性,而NaHSO3溶液却略显酸性. NaHSO3溶液略显酸性是因为亚硫酸氢离子电离大于水解.
Ⅱ、0.1mol•L-1的NaHCO3溶液和Na2SO3溶液的pH相近,Na2SO3溶液却能阻止苹果褐变,结合离子方程式分析原因:亚硫酸钠的还原性比酚强,消耗了氧气,保护了酚;2SO32-+O2═2SO42-,
Ⅲ、对探究2中的试验③所得结论作进一步解释酶是蛋白质,在强酸、强碱或加热条件下会变性,失去活性;.
A.苹果中的Fe2+被空气中的氧气氧化成了Fe3+
B.苹果中的酚类物质被空气中的氧气氧化了
究竟哪种说法正确,某小组同学通过实验进行了探究.
实验用品:苹果、浓度均为0.1mol•L-1的盐酸、NaHCO3溶液、Na2SO3溶液,KSCN溶液,去氧蒸馏水.
(1)探究1:
| 实验操作 | 实验现象 | 结论 |
| 在“褐变”后的苹果上滴上2~3滴 KSCN溶液. | 无红色出现 | 说法A不正确 |
【查阅文献】
苹果中含有多种酚和酚氧化酶,苹果中酚氧化酶的活性温度为35℃左右、活性pH约为5.5-7.5.
Ⅱ.酚类物质遇FeCl3溶液常发生显色反应而呈现一定颜色,如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色.
该小组将刚削皮的苹果切成七块,分别进行如下实验.请填写下表中相应的结论:
| 序号 | 实验步骤 | 现 象 | 结 论 |
| ① | 在一块上滴加2~3滴FeCl3溶液 | 表面变为绿色 | 对苯二酚 |
| ② | 再取两块,一块放置于空气中,另一块迅速浸入经过去氧的蒸馏水中. | 前者表面逐渐褐变,后者相当长一段时间内,无明显变化. | 苹果褐变与氧气有关 |
| ③ | 另两块分别立刻放入沸水和0.1mol•L-1盐酸中浸泡2min后取出,置于空气中. | 相当长一段时间内,两块均无明显变化. | 苹果褐变与酚氧化酶的活性有关 |
| ④ | 最后两块分别立刻放入浓度均为0.1mol•L-1的NaHCO3和Na2SO3溶液里浸泡2min后取出,置于空气中. | 前者经过一段时间表面逐渐褐变,后者相当长一段时间内,无明显变化. | 亚硫酸钠溶液能阻止苹果褐变 |
Ⅰ、常温下,浓度均为0.1mol•L -1 NaHCO3溶液略显碱性,而NaHSO3溶液却略显酸性. NaHSO3溶液略显酸性是因为亚硫酸氢离子电离大于水解.
Ⅱ、0.1mol•L-1的NaHCO3溶液和Na2SO3溶液的pH相近,Na2SO3溶液却能阻止苹果褐变,结合离子方程式分析原因:亚硫酸钠的还原性比酚强,消耗了氧气,保护了酚;2SO32-+O2═2SO42-,
Ⅲ、对探究2中的试验③所得结论作进一步解释酶是蛋白质,在强酸、强碱或加热条件下会变性,失去活性;.
2.一定量的Fe和Fe2O3的混合物投入250ml密度为1.065g.cm-3、物质的量浓度为2mol•L-1的HNO3溶液中,固体恰好完全溶解,生成Fe(NO3)2和1.12LNO(标况下,且假定HNO3还原产物仅此一种).向反应后的溶液中加入1mol•L-1NaOH溶液,使铁元素完全沉淀下来,下列说法正确的是( )
| A. | 混合物中含有0.05molFe元素 | |
| B. | 该硝酸溶液中溶质的质量分数是63% | |
| C. | 所加入NaOH溶液的体积最少是450mL | |
| D. | 反应中HNO3被氧化,生成氧化产物NO |
9.W、X、Y、Z为原子序数依次增大的短周期主族元素,它们的最外层电子数总和为12,W属于非金属元素且与X同主族,X+、Y3+均与氖原子电子层结构相同.下列说法正确的是( )
| A. | 单质的还原性:W>X>Y | |
| B. | 原子半径:X>Y>Z>W | |
| C. | X的最高价氧化物对应水化物的碱性比Y的弱 | |
| D. | 化合物XYW4具有强氧化性 |
6.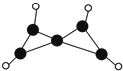 科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法不正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法不正确的是( )
 科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法不正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法不正确的是( )| A. | X在常温下不能稳定存在 | |
| B. | X的性质与烯烃类似,容易发生加成反应 | |
| C. | X不能使酸性KMnO4溶液褪色 | |
| D. | 充分燃烧等质量的X和甲烷,X消耗氧气比甲烷少 |
7.X、Y、Z、W、M为原子序数依次增大的短周期主族元素.已知:
①元素对应的原子半径大小为:X<Z<Y<M<W;
②Y是组成有机物的必要元素
③Z与X可形成两种常见的共价化合物,与W可形成两种常见的离子化合物;
④M的电子层数与最外层电子数相等.
下列说法不正确的是( )
①元素对应的原子半径大小为:X<Z<Y<M<W;
②Y是组成有机物的必要元素
③Z与X可形成两种常见的共价化合物,与W可形成两种常见的离子化合物;
④M的电子层数与最外层电子数相等.
下列说法不正确的是( )
| A. | W、M的离子半径及最高价氧化物对应水化物的碱性皆为M<W | |
| B. | YZ2为直线型的共价化合物,W2Z2既含有离子键又含有共价键 | |
| C. | Y与X形成的化合物的熔沸点一定低于Z与X形成的化合物的熔沸点 | |
| D. | Z与M形成的化合物可作为耐高温材料,W、M、X以1:1:4组成的化合物是应用前景很广泛的储氢材料,具有很强的还原性 |
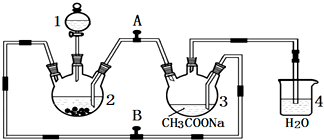
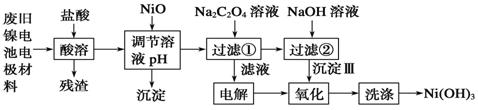
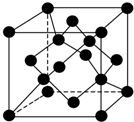 自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:
自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题: