题目内容
19.固体X中可能含有MgCl2、Na2CO3、K2SO3、KAlO2中的一种或几种.为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如下:
根据上述实验,下列说法正确的是( )
| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Al(OH)3 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |
分析 固体X中加入过量的硝酸,得溶液2,加入氯化钡生成沉淀4,说明固体中含有K2SO3,加入稀硝酸发生氧化还原反应生成NO气体,气体1一定含有NO,可能含有二氧化碳,则可能含有Na2CO3,向溶液2中加入氨水有沉淀生成,沉淀可能是Mg(OH)2和Al(OH)3的混合物,
所以固体中一定含有K2SO3,可能含有Na2CO3,MgCl2、KAlO2至少存在一种,以此解答该题.
解答 解:固体X中加入过量的硝酸,得溶液2,加入氯化钡生成沉淀4,说明固体中含有K2SO3,加入稀硝酸发生氧化还原反应生成NO气体,气体1一定含有NO,可能含有二氧化碳,则可能含有Na2CO3,向溶液2中加入氨水有沉淀生成,沉淀可能是Mg(OH)2和Al(OH)3的混合物,
所以固体中一定含有K2SO3,可能含有Na2CO3,MgCl2、KAlO2至少存在一种,
A.稀硝酸的强氧化性,气体1不可能为SO2,两者要发生氧化还原反应,故A错误;
B.由以上分析可知沉淀可能是Mg(OH)2和Al(OH)3的混合物,故B正确;
C.加入过量硝酸,溶液中不可能存在碳酸根离子和亚硫酸根离子,则沉淀4不可能为BaCO3、BaSO3或二者混合物,故C错误;
D.加入稀硝酸发生氧化还原反应生成NO气体,气体1一定含有NO,可能含有二氧化碳,则不一定含有碳酸钠,故D错误.
故选B.
点评 本题考查物质的分离提纯实验设计,为高频考点,把握物质的性质及流程中发生的反应为解答的关键,侧重混合物分离方法、原理及分析应用能力的考查,题目难度不大.

练习册系列答案
相关题目
9.目前用乙烯制乙醛的过程分三步进行:
①CH2=CH2+PbCl2+H2O→CH3CHO+2HCl+Pb;
②Pb+2CuCl2→PbCl2+2CuCl2;
③2CuCl2+$\frac{1}{2}$O2+2HCl→2CuCl2+H2O.
下列叙述中正确的是( )
①CH2=CH2+PbCl2+H2O→CH3CHO+2HCl+Pb;
②Pb+2CuCl2→PbCl2+2CuCl2;
③2CuCl2+$\frac{1}{2}$O2+2HCl→2CuCl2+H2O.
下列叙述中正确的是( )
| A. | CH2=CH2是还原剂,PbCl2是氧化剂 | B. | CuCl2是还原剂,O2是氧化剂 | ||
| C. | 乙烯是还原剂,O2是氧化剂 | D. | PbCl2和CuCl2都是氧化剂 |
4.用惰性电极进行电解,下列说法正确的是( )
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液pH不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 | |
| C. | 电解硫酸铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:2 | |
| D. | 电解氯化铜溶液,消耗完氯化铜后电解就会停止 |
11.研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是( )
| A. | 蒸馏常用于分离提纯液态有机混合物 | |
| B. | 核磁共振氢谱通常用于分析有机物中氢的个数 | |
| C. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 | |
| D. | 燃烧法是研究确定有机物元素组成的有效方法 |
9.下列有关石油和煤的利用叙述不正确的是( )
| A. | 煤的干馏就是将煤隔绝空气在高温使之分解,得到焦炭、煤焦油等物质的过程 | |
| B. | 煤的液化就是将煤转化成甲醇、乙醇等其液态物质的过程 | |
| C. | 煤的气化就是将煤在高温条件由固态转化为气态的物理变化过程 | |
| D. | 通过催化裂化或裂解,可以获得碳原子数较少的轻质油 |
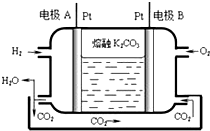 一种新型氢氧燃料电池工作原理如图所示.
一种新型氢氧燃料电池工作原理如图所示.