题目内容
10.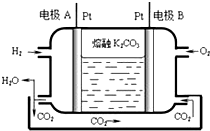 一种新型氢氧燃料电池工作原理如图所示.
一种新型氢氧燃料电池工作原理如图所示.(1)写出电极A的电极反应式H2-2e-+CO32-=CO2+H2O.
(2)以上述电池电解饱和食盐水,若生成0.2mol Cl2,则至少需通入O2的体积为1.12L(标准状况)
分析 (1)氢氧燃料电池的负极氢气发生氧化反应,正极上发生得电子的还原反应,据此书写电极反应;
(2)电解饱和食盐水,总反应为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,据电子守恒计算回答.
解答 解:(1)氢氧燃料电池的负极氢气发生氧化反应,电极反应为:H2-2e-+CO32-=CO2+H2O,故答案为:H2-2e-+CO32-=CO2+H2O;
(2)电解饱和食盐水,总反应为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,若生成0.2molCl2,转移电子是0.2mol,原电池正极上发生反应:O2+4e-+2CO2=2CO32-,所以需通入O2的体积为$\frac{0.2mol}{4}$×22.4L/mol=1.12L,故答案为:1.12L.
点评 本题考查电化学的相关知识,学生要掌握原电池的工作原理,以及在电子转移相等的情况下的有关计算,难度中等.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
1.下列说法正确的是( )
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 在化合物Na2O2中,阴、阳离子的个数比为1:1 | |
| C. | 在化合物CaCl2中,两个氯离子之间存在共价键 | |
| D. | 含有离子键的化合物一定是离子化合物 |
5.含元素种类最少的物质是( )
| A. | 新制氯水 | B. | 久置氯水 | C. | 重水 | D. | 海水 |
15.下列属于氧化物的是( )
| A. | H2SO4 | B. | Ca(OH)2 | C. | KClO3 | D. | CO 2 |
19.固体X中可能含有MgCl2、Na2CO3、K2SO3、KAlO2中的一种或几种.为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如下:

根据上述实验,下列说法正确的是( )

根据上述实验,下列说法正确的是( )
| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Al(OH)3 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |
20.把Ba(OH)2溶液滴入明矾(KAl(SO4)2•12H2O)溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
| A. | Al3+ | B. | Al(OH)3 | C. | [Al(OH)4]- | D. | Al3+和Al(OH)3 |
