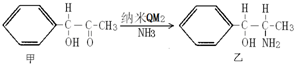
题目内容
9.目前用乙烯制乙醛的过程分三步进行:①CH2=CH2+PbCl2+H2O→CH3CHO+2HCl+Pb;
②Pb+2CuCl2→PbCl2+2CuCl2;
③2CuCl2+$\frac{1}{2}$O2+2HCl→2CuCl2+H2O.
下列叙述中正确的是( )
| A. | CH2=CH2是还原剂,PbCl2是氧化剂 | B. | CuCl2是还原剂,O2是氧化剂 | ||
| C. | 乙烯是还原剂,O2是氧化剂 | D. | PbCl2和CuCl2都是氧化剂 |
分析 在氧化还原反应中,得电子化合价降低的物质作氧化剂,失电子化合价升高的物质作还原剂,据此分析解答.
解答 解:①CH2=CH2+PdCl2+H2O→CH3CHO+2HCl+Pd
②Pd+2CuCl2=PdCl2+2CuCl的反应中
③2CuCl+1/2O2+2HCl=2CuCl2+H2O
将方程式①+②+③得CH2=CH2+$\frac{1}{2}$O2=CH3CHO,该反应中氧气是氧化剂,乙烯是还原剂;
A.乙烯是还原剂,PdCl2是催化剂,故A错误;
B.氯化亚铜催化剂,氧气是氧化剂,故B错误;
C.乙烯是还原剂,氧气是氧化剂,故C正确;
D.PdCl2和CuCl都是催化剂,故D错误;
故选C.
点评 本题考查了氧化还原反应中还原剂、还原剂的判断,难度不大,明确元素的化合价是解本题的关键,注意PdCl2和CuCl都是催化剂,为易错点.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
4.下列说法错误的是( )
| A. | 反应产物的总焓与反应物的总焓之差,称为反应焓变 | |
| B. | 反应产物的总焓小于反应物的总焓,该反应为放热反应 | |
| C. | 同一反应在不同温度下进行,其焓变是相同的 | |
| D. | 已知2NO2(g)═N2O4(g)△H1,N2O4(g)═2NO2(g)△H2,则△H1=-△H2 |
1.下列说法正确的是( )
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 在化合物Na2O2中,阴、阳离子的个数比为1:1 | |
| C. | 在化合物CaCl2中,两个氯离子之间存在共价键 | |
| D. | 含有离子键的化合物一定是离子化合物 |
19.固体X中可能含有MgCl2、Na2CO3、K2SO3、KAlO2中的一种或几种.为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如下:

根据上述实验,下列说法正确的是( )

根据上述实验,下列说法正确的是( )
| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Al(OH)3 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |


 已知X、Y、Z、M、Q五种元素的原子序数依次递增;X、Y、M三种元素组成的一种化合物A是新装修居室中常含有的一种有害气体.Q4+离子和氩原子的核外电子排布相同.
已知X、Y、Z、M、Q五种元素的原子序数依次递增;X、Y、M三种元素组成的一种化合物A是新装修居室中常含有的一种有害气体.Q4+离子和氩原子的核外电子排布相同.