题目内容
8.铁的化合物在化学研究中受到广泛重视,请回答下列问题:(1)一种光敏材料的化学式是KxFe(C2O4)y•3H2O( Fe为+3价),为测定其组成,称取一定质量的晶体置于烧杯中,加入足量的蒸馏水和稀 H2SO4,将 C2O42-转化为 H2C2O4后用 0.1020mol/L的KMnO4溶液滴定,当消耗 KMnO4溶液 24.48mL 时恰好完全反应;再向溶液中加入适量的还原剂,恰好将 Fe3+完全转化为 Fe2+,用相同浓度的 KMnO4溶液继续滴定,当 Fe2+完全被氧化时,用去 KMnO4溶液 4.08mL.写出KMnO4溶液与H2C2O4反应的离子方程式2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O.
通过计算确定该材料的组成K3Fe(C2O4)3•3H2O.
(2)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化.已知含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(3)纳米级Fe3O4是磁流体中的重要粒子,其制备原理可简单表示如下:
①将化合物NH3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中生成两种碱,写出该反应过程的离子方程式Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+.
②上述反应生成的两种碱继续作用,得到Fe3O4,该反应的化学方程式为Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O.
(4)复合氧化物铁酸锰(MnFe2O4)可以用于热化学循环分解水制氢,利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4$\stackrel{>1000K}{→}$MnFe2O4-x+$\frac{x}{2}$O2↑ MnFe2O4-x+xH2O→MnFe2O4+xH2↑,
若MnFe2O4-x中x=0.6,则MnFe2O4-x中Fe2+占全部铁元素的百分率为60%.
分析 (1)先滴加高锰酸钾,发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O,根据关系式:5C2O42-~5H2C2O4~2KMnO4计算n(C2O42-),再加入还原剂,Fe3+完全转化为 Fe2+,用相同浓度的 KMnO4溶液继续滴定,根据关系式5Fe3+~5Fe2+~MnO4-计算n(Fe3+),根据n (Fe3+):n (C2O42-)确定y的值,再根据电荷守恒确定x,进而确定化学式;
(2)铁离子具有强氧化性,将二氧化硫氧化所生产的硫酸,自身还原得到亚铁离子;
(3)①硫酸亚铁、硫酸铁与氨水反应生成氢氧化亚铁、氢氧化铁与硫酸铵;
②由题意可知,氢氧化铁、氢氧化铁作用得到四氧化三铁与水;
(4)根据化合价代数和为0,计算MnFe2O4-x中铁的总价态,令1mol MnFe2O4-x中含Fe2+、Fe3+物质的量分别为xmol、ymol,列方程组解答.
解答 解:(1)先滴加高锰酸钾,发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O,离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O,
根据关系式:5C2O42-~5H2C2O4~2KMnO4,可知n(C2O42-)=$\frac{5}{2}$n(MnO4-)=$\frac{5}{2}$×0.1020×24.48×10-3 mol,
再加入还原剂,Fe3+完全转化为 Fe2+,用相同浓度的 KMnO4溶液继续滴定,根据关系式5Fe3+~5Fe2+~MnO4-,可知n (Fe3+)=n( Fe2+)=5n(MnO4-)=5×0.1020×4.08×10-3 mol,
故n (Fe3+):n (C2O42-)=1:3,所以y=3,由电荷守恒可知x+3=2y,即x+3=3×2,解得x=3,
故化学式为 K3Fe(C2O4)3•3H2O,
故答案为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O,K3Fe(C2O4)3•3H2O;
(2)铁离子具有强氧化性,将二氧化硫氧化所生产的硫酸,自身还原得到亚铁离子,反应离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(3)①硫酸亚铁、硫酸铁与氨水反应生成氢氧化亚铁、氢氧化铁与硫酸铵,反应离子方程式为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+,
故答案为:Fe2++2Fe3++8NH3+8H2O═Fe(OH)2↓+2Fe(OH)3↓+8NH4+;
②由题意可知,氢氧化铁、氢氧化铁作用得到四氧化三铁与水,化学方程式为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O,
故答案为:Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O;
(4)x=0.6时,铁的总价态为(4-0.6)×2-2=4.8,设1mol MnFe2O3.4中含Fe2+、Fe3+物质的量分别为xmol、ymol,
则有x+y=2,2x+3y=4.8,
联立解得:x=1.2,y=0.8,
则1mol MnFe2O3.6中含Fe2+的物质的量为1.2mol,则Fe2+占的百分率为$\frac{1.2mol}{2mol}$×100%=60%.
故答案为:60%.
点评 本题考查氧化还原反应滴定计算、方程式书写、物质组成的计算等,(1)中计算量较大,注意利用关系式计算,需要学生具备扎实的基础,难度中等.

 ABC考王全优卷系列答案
ABC考王全优卷系列答案
根据上述实验,下列说法正确的是( )
| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Al(OH)3 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |
| A. | 乙炔的电子式: | B. |  和 和 是同一物质 是同一物质 | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 乙烯的球棍模型: |
| A. | CO2 | B. | NH3 | C. | H2O | D. | CH4 |
| A. | 该元素的原子序数是72 | B. | 该元素的原子序数是113 | ||
| C. | 该核素的中子数为72 | D. | 该元素的相对原子质量为了185 |
| A. | Al3+ | B. | Al(OH)3 | C. | [Al(OH)4]- | D. | Al3+和Al(OH)3 |
| A. | SrO可与盐酸反应 | B. | Sr(OH)2难溶于水 | C. | SrSO4难溶于水 | D. | Sr(OH)2是强碱 |
| A. | 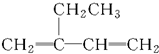 2-乙基-1,3-丁二烯 2-乙基-1,3-丁二烯 | B. | CH2=CH-CH2-CH3 1-丁烯 | ||
| C. | 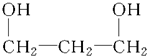 1,3-二丙醇 1,3-二丙醇 | D. | 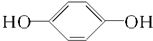 1,4-苯二酚 1,4-苯二酚 |