题目内容
某粒子的结构示意图为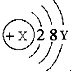 ,试回答:
,试回答:
(1)当x-y=10时,该粒子为 (填“原子”、“阳离子”或“阴离子”).
(2)当y=8时,该粒子可能是(写名称) 、 、 、 、 .
(3)若该粒子为原子,写出y=3与y=6时的元素最高价氧化物对应水化物的化学式分别为 、 .
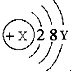 ,试回答:
,试回答:(1)当x-y=10时,该粒子为
(2)当y=8时,该粒子可能是(写名称)
(3)若该粒子为原子,写出y=3与y=6时的元素最高价氧化物对应水化物的化学式分别为
考点:分子、原子、离子,原子结构示意图
专题:
分析:(1)根据核内质子数与核外电子数是否相等判断粒子的类型;
(2)先根据离子中核内质子数不等于核外电子数,得出离子的核内质子数,依此判断离子种类.
(2)先根据离子中核内质子数不等于核外电子数,得出离子的核内质子数,依此判断离子种类.
解答:
解:(1)当x-y=10时,核内质子数为x,核外电子数为2+8+y,两者相等,所以该粒子为原子,
故答案为:原子;
(2)当y=8时,该离子的核外电子数为18,而离子中核内质子数不等于核外电子数,则该离子的核内质子数可能为:20、19、17、16等,所以这些粒子为Cl-、S2-、K+、Ca2+,可能的名称为氩原子、氯离子、硫离子、钾离子、钙离子;
故答案为:氩原子、氯离子、硫离子、钾离子、钙离子;
(3)若该粒子为原子,y=3为铝元素时的元素最高价氧化物对应水化物的化学式为Al(OH)3,y=6时为硫元素,元素最高价氧化物对应水化物的化学式为H2SO4;
故答案为:Al(OH)3;H2SO4.
故答案为:原子;
(2)当y=8时,该离子的核外电子数为18,而离子中核内质子数不等于核外电子数,则该离子的核内质子数可能为:20、19、17、16等,所以这些粒子为Cl-、S2-、K+、Ca2+,可能的名称为氩原子、氯离子、硫离子、钾离子、钙离子;
故答案为:氩原子、氯离子、硫离子、钾离子、钙离子;
(3)若该粒子为原子,y=3为铝元素时的元素最高价氧化物对应水化物的化学式为Al(OH)3,y=6时为硫元素,元素最高价氧化物对应水化物的化学式为H2SO4;
故答案为:Al(OH)3;H2SO4.
点评:本题主要考查微粒结构,核电荷数、原子序数、核外电子数之间的关系,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关物质的性质和该性质的应用均正确的是( )
| A、铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓外壳的腐蚀 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、二氧化氯具有还原性,可用于自来水的杀菌消毒 |
| D、常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮藏贮运浓硫酸 |
CH4、NH3、H2O和HF分子中,共价键的极性由强到弱的顺序是( )
| A、CH4、NH3、H2O、HF |
| B、HF、NH3、H2O、CH4 |
| C、H2O、HF、CH4、NH3 |
| D、HF、H2O、CH4、NH3 |
已知Zn(s)+
O2(g)═ZnO(s)△H=-350kJ/mol,则1g Zn在氧气中燃烧放出的热量约为( )
| 1 |
| 2 |
| A、5.4 kJ |
| B、350 kJ |
| C、3.5 kJ |
| D、8.5 kJ |
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A、1 mol碳正离子(CH3+)所含的电子总数为8 NA |
| B、1 mol甲基(-CH3)所含的电子总数为9NA |
| C、0.5mol 1,3-丁二烯分子中含有C=C双键数为 NA |
| D、标准状况下,22.4L庚烷完全燃烧所生成的气态产物的分子数为7NA |
下列关于元素周期表和元素周期律的说法错误的是( )
| A、Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 |
| B、第二周期元素从Li到F,非金属性逐渐减弱 |
| C、因为Na比K容易失去电子,所以Na比K的还原性强 |
| D、O与S为同主族元素,且O比S的非金属性强 |
下列说法正确的是( )
| A、电解AlCl3、FeCl3、CuCl2的混合溶液,阴极上依次析出Cu、Fe、Al |
| B、CO、NO、NO2、SO2都是大气污染气体,在空气中都能稳定存在 |
| C、在氨水中加入少量水,水的电离平衡向逆反应方向移动 |
| D、浓硫酸具有强氧化性,常温下能与铜发生剧烈反应 |