题目内容
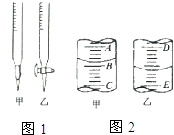
如图是实验室制取气体的一种发生装置.
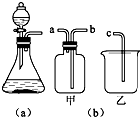 (1)若用上述装置制取O2,除了可选择二氧化锰和 (物质名称)反应外,还能选择 (填物质的化学式)和水反应,写出后一个反应的化学方程式: .
(1)若用上述装置制取O2,除了可选择二氧化锰和 (物质名称)反应外,还能选择 (填物质的化学式)和水反应,写出后一个反应的化学方程式: .
(2)用排空气法收集H2,可选择图(b)中的甲装置,收集时气体应从 口进气.(填“a”或“b”)
(3)实验室以KMnO4和浓盐酸为反应物,利用(a)、(b)装置组合制取氯气,反应方程式如下:
KMnO4+ HCl═ KCl+ MnCl2+ Cl2↑+ H2O
①配平上述反应方程式(在空格里填上适合的化学计量数).
②组合装置乙中盛放氢氧化钠溶液,其作用为 ,发生反应的离子方程式为 .
(4)广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其他简单仪器组成各种用途的装置.
如充当集气瓶,还可作 , (填写两种即可).
 (1)若用上述装置制取O2,除了可选择二氧化锰和
(1)若用上述装置制取O2,除了可选择二氧化锰和(2)用排空气法收集H2,可选择图(b)中的甲装置,收集时气体应从
(3)实验室以KMnO4和浓盐酸为反应物,利用(a)、(b)装置组合制取氯气,反应方程式如下:
①配平上述反应方程式(在空格里填上适合的化学计量数).
②组合装置乙中盛放氢氧化钠溶液,其作用为
(4)广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其他简单仪器组成各种用途的装置.
如充当集气瓶,还可作
考点:制备实验方案的设计,实验装置综合
专题:
分析:(1)图中为固体与液体不加热制取气体的装置,则选择二氧化锰与过氧化氢反应,或过氧化钠与水反应等;
(2)排空气法收集H2,采取向下排空气法;
(3)①反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数;
②氯气有毒,不能排放在空气中,选择NaOH吸收尾气;
(4)由图中甲可知,导管长进短出可除杂,短进长出可防止倒吸等.
(2)排空气法收集H2,采取向下排空气法;
(3)①反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数;
②氯气有毒,不能排放在空气中,选择NaOH吸收尾气;
(4)由图中甲可知,导管长进短出可除杂,短进长出可防止倒吸等.
解答:
解:(1)图中为固体与液体不加热制取气体的装置,则选择二氧化锰与过氧化氢反应,或Na2O2与水反应等,均可制取氧气,过氧化钠与水的反应为2Na2O2+2H2O═4NaOH+O2↑,故答案为:过氧化氢;Na2O2;2Na2O2+2H2O═4NaOH+O2↑;
(2)排空气法收集H2,采取向下排空气法,则由图可知,从a口进气,故答案为:a;
(3)①反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的方程式为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
故答案为:2;16;2;2;5;8;
②氯气有毒,不能排放在空气中,选择NaOH吸收尾气,则NaOH的作用为吸收多余的氯气,防止污染空气,发生的离子反应为Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:吸收多余的氯气,防止污染空气;Cl2+2OH-═Cl-+ClO-+H2O;
(4)由图中甲可知,导管长进短出可除杂,则可作洗气瓶;短进长出可防止倒吸,则可作安全瓶,故答案为:洗气瓶;安全瓶.
(2)排空气法收集H2,采取向下排空气法,则由图可知,从a口进气,故答案为:a;
(3)①反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的方程式为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
故答案为:2;16;2;2;5;8;
②氯气有毒,不能排放在空气中,选择NaOH吸收尾气,则NaOH的作用为吸收多余的氯气,防止污染空气,发生的离子反应为Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:吸收多余的氯气,防止污染空气;Cl2+2OH-═Cl-+ClO-+H2O;
(4)由图中甲可知,导管长进短出可除杂,则可作洗气瓶;短进长出可防止倒吸,则可作安全瓶,故答案为:洗气瓶;安全瓶.
点评:本题考查常见气体的制备实验,为高频考点,把握气体的制备原理及实验装置的作用为解答的关键,侧重分析及实验能力的考查,题目难度不大.

练习册系列答案
相关题目
若1mol 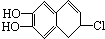 分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )
分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )
 分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )
分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )| A、1mol、2mol |
| B、2mol、3mol |
| C、3mol、2mol |
| D、3mol、3mol |
锌与100mL1mol/L盐酸反应的实验中,若设想向溶液中加入少量的①醋酸钠或②溴化铜或③醋酸铜(均为可溶性),并测定生成H2的速率(mL/min),预计三种方案的速率大小是( )
| A、①>③>② |
| B、③>②>① |
| C、②>③>① |
| D、①>②>③ |
向27.2g Cu和Cu2O(物质的量之比为2:1)的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2.在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子恰好完全沉淀?下列有关说法错误的是( )
| A、混合物中Cu的物质的量为0.2 mol |
| B、产生的NO在标准状况下的体积为4.48L |
| C、硝酸的物质的量浓度为2.6mol/L |
| D、Cu?Cu2O与硝酸反应后剩余HNO3为0.2mol |
NaHCO3受热容易分解为Na2CO3. 现加热5.00g的NaHCO3和Na2CO3的混合物,使NaHCO3完全分解,混合物质量减少了0.31g,则原混合物中Na2CO3的质量为( )
| A、3.38g |
| B、34.58g |
| C、4.16g |
| D、34.41g |
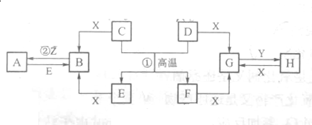 已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).
已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).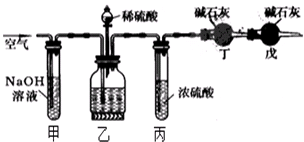 工业生产的纯碱中常含有少量的NaCl杂质,某校研究性活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.
工业生产的纯碱中常含有少量的NaCl杂质,某校研究性活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.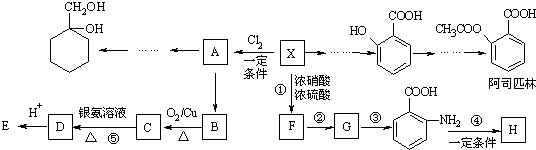
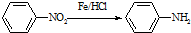 (苯胺,易被氧化)
(苯胺,易被氧化)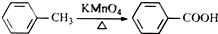
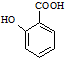 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有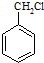 和其他无机物合成
和其他无机物合成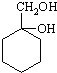 最合理的方案(不超过4步).例:
最合理的方案(不超过4步).例:
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空: