题目内容
反应A(g)+3B(g)═2C(g)+2D(g)在四种不同情况下的反应速率分别为:
①v(A)=0.45mol/(L?s) ②v(B)=0.6mol/(L?s)
③v(C)=0.4mol/(L?s) ④v(D)=0.45mol/(L?s)
下列有关反应速率的比较中正确的是( )
①v(A)=0.45mol/(L?s) ②v(B)=0.6mol/(L?s)
③v(C)=0.4mol/(L?s) ④v(D)=0.45mol/(L?s)
下列有关反应速率的比较中正确的是( )
| A、④>③=②>① |
| B、④<③=②<① |
| C、①>②>③>④ |
| D、④>③>②>① |
考点:化学反应速率和化学计量数的关系
专题:化学反应速率专题
分析:根据反应速率与化学计量数的比值越大,则反应速率越大,以此来解答.
解答:
解:反应速率与化学计量数的比值越大,则反应速率越大,则
①
=0.45;
②
=0.2;
③
=0.2;
④
=0.225,
则反应速率为④<③=②<①,
故选B.
①
| 0.45 |
| 1 |
②
| 0.6 |
| 3 |
③
| 0.4 |
| 2 |
④
| 0.45 |
| 2 |
则反应速率为④<③=②<①,
故选B.
点评:本题考查反应速率的比较,为高频考点,把握反应速率与化学计量数的关系及比值法比较反应速率为解答的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式书写不正确的是( )
| A、将金属Na投入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| B、在硫酸溶液中加入氢氧化钡溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| C、氯化铁溶液与铁反应:2Fe3++Fe=3Fe2+ |
| D、碳酸钙中滴加盐酸:CO32-+2H+=CO2↑+H2O |
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质的一种或两种,现将13.8g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液得到9克沉淀,对样品所含杂质的正确判断是( )
| A、肯定没有KNO3 |
| B、肯定没有Ba(NO3)2和KNO3 |
| C、肯定没有Ba(NO3)2,可能有Na2CO3 |
| D、肯定没有Ba(NO3)2,可能有KNO3 |
若1mol 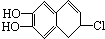 分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )
分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )
 分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )
分别与浓溴水和NaOH溶液完全反应,消耗Br2和NaOH的物质的量分别是( )| A、1mol、2mol |
| B、2mol、3mol |
| C、3mol、2mol |
| D、3mol、3mol |
锌与100mL1mol/L盐酸反应的实验中,若设想向溶液中加入少量的①醋酸钠或②溴化铜或③醋酸铜(均为可溶性),并测定生成H2的速率(mL/min),预计三种方案的速率大小是( )
| A、①>③>② |
| B、③>②>① |
| C、②>③>① |
| D、①>②>③ |
向27.2g Cu和Cu2O(物质的量之比为2:1)的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2.在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子恰好完全沉淀?下列有关说法错误的是( )
| A、混合物中Cu的物质的量为0.2 mol |
| B、产生的NO在标准状况下的体积为4.48L |
| C、硝酸的物质的量浓度为2.6mol/L |
| D、Cu?Cu2O与硝酸反应后剩余HNO3为0.2mol |
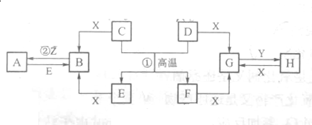 已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).
已知D、E、Z是单质,其他都是化合物.D既能与强酸反应,又能与强碱反应;潮湿的Z有漂白性;Y的焰色反应显黄色.除反应①外,其他反应均在水溶液中进行,转化关系如图所示(部分物质条件已略去).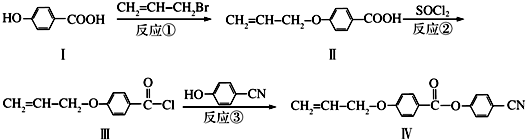
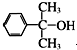 也可与Ⅲ发生类似反应③的反应生成有机物V.V的结构简式是
也可与Ⅲ发生类似反应③的反应生成有机物V.V的结构简式是