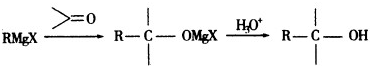题目内容
用中和滴定法测定某烧碱样品的纯度,有以下步骤:
(1)配制待测液:用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要的玻璃仪器有 ;
(2)滴定:①盛装0.1000mol/L的盐酸标准液应该使用 式滴定管;
②滴定时双眼应 .
(3)有关数据记录如下:
计算烧碱样品的纯度是 ;
(4)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,会使测定结果 ;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,会使测定结果 ;
③读数时,滴定前仰视,滴定后俯视,会使测定结果 ;
④装标准液之前,没有用标准液润洗滴定管,会使测定结果 .
(1)配制待测液:用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要的玻璃仪器有
(2)滴定:①盛装0.1000mol/L的盐酸标准液应该使用
②滴定时双眼应
(3)有关数据记录如下:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
(4)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,会使测定结果
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,会使测定结果
③读数时,滴定前仰视,滴定后俯视,会使测定结果
④装标准液之前,没有用标准液润洗滴定管,会使测定结果
考点:中和滴定
专题:
分析:(1)配制一定物质的量浓度的氢氧化钠溶液需要仪器:容量瓶、胶头滴管、烧杯、玻璃棒、天平、药匙等;
(2)①酸性溶液应用酸式滴定管盛放;②滴定时眼睛注视锥形瓶中颜色变化;
(3)先算出两次消耗盐酸的平均体积,然后求出氢氧化钠的物质的量,再计算烧碱样品的纯度;
(4)①用蒸馏水冲洗锥形瓶,不影响待测物的总物质的量;
②滴定过程中不慎将酸滴在瓶外,消耗盐酸的体积偏多;
③滴定前仰视、滴定后俯视,消耗盐酸体积偏小;
④未用标准液润洗滴定管,消耗盐酸体积偏大,
(2)①酸性溶液应用酸式滴定管盛放;②滴定时眼睛注视锥形瓶中颜色变化;
(3)先算出两次消耗盐酸的平均体积,然后求出氢氧化钠的物质的量,再计算烧碱样品的纯度;
(4)①用蒸馏水冲洗锥形瓶,不影响待测物的总物质的量;
②滴定过程中不慎将酸滴在瓶外,消耗盐酸的体积偏多;
③滴定前仰视、滴定后俯视,消耗盐酸体积偏小;
④未用标准液润洗滴定管,消耗盐酸体积偏大,
解答:
解:(1)配制1000mL一定物质的量浓度的氢氧化钠溶液需要仪器:1000mL容量瓶、胶头滴管、烧杯、玻璃棒、天平、药匙,所以配制待测液还需要的玻璃仪器有1000mL容量瓶、玻璃棒、胶头滴管,烧杯;
故答案为:1000mL容量瓶;
(2))①盛装0.1000mol?L-1盐酸标准液应该使用酸式滴定管;②滴定时双眼应注意观察锥形瓶内溶液颜色的变化;
故答案为:酸;注意观察锥形瓶内溶液颜色的变化;
(3)两次消耗盐酸体积分别为:20.28ml、20.12ml,所以消耗盐酸的平均体积为20.20mL,原溶液n(NaOH)=50×n(HCl)=50×0.10 mol/L×20.20mL×10-3=0.101mol,所以1000mL待测溶液含有m(烧碱)═0.808g×50=4.04g,所以烧碱的纯度为 烧碱的纯度ω(烧碱)=
×100%=80.8%,
故答案为:80.8%;
(4)①冲洗锥形瓶,不影响待测物的总物质的量,不会影响测定结果;
②滴定过程中不慎将酸滴在瓶外,消耗盐酸的体积偏多,测定结果偏大;
③滴定前仰视、滴定后俯视,消耗盐酸体积偏小,测定结果偏小;
④装标准液之前,没有用标准液润洗滴定管,标准液浓度减小,消耗的盐酸增多,测定结果偏高;
故答案为:①无影响 ②偏高 ③偏低 ④偏高;
故答案为:1000mL容量瓶;
(2))①盛装0.1000mol?L-1盐酸标准液应该使用酸式滴定管;②滴定时双眼应注意观察锥形瓶内溶液颜色的变化;
故答案为:酸;注意观察锥形瓶内溶液颜色的变化;
(3)两次消耗盐酸体积分别为:20.28ml、20.12ml,所以消耗盐酸的平均体积为20.20mL,原溶液n(NaOH)=50×n(HCl)=50×0.10 mol/L×20.20mL×10-3=0.101mol,所以1000mL待测溶液含有m(烧碱)═0.808g×50=4.04g,所以烧碱的纯度为 烧碱的纯度ω(烧碱)=
| 4.04g |
| 5.00g |
故答案为:80.8%;
(4)①冲洗锥形瓶,不影响待测物的总物质的量,不会影响测定结果;
②滴定过程中不慎将酸滴在瓶外,消耗盐酸的体积偏多,测定结果偏大;
③滴定前仰视、滴定后俯视,消耗盐酸体积偏小,测定结果偏小;
④装标准液之前,没有用标准液润洗滴定管,标准液浓度减小,消耗的盐酸增多,测定结果偏高;
故答案为:①无影响 ②偏高 ③偏低 ④偏高;
点评:本题考查了滴定操作.操作时要规范,分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响.

练习册系列答案
相关题目
锌与100mL1mol/L盐酸反应的实验中,若设想向溶液中加入少量的①醋酸钠或②溴化铜或③醋酸铜(均为可溶性),并测定生成H2的速率(mL/min),预计三种方案的速率大小是( )
| A、①>③>② |
| B、③>②>① |
| C、②>③>① |
| D、①>②>③ |
有NaCl、FeCl3、CuCl2、CaCO3,能区分他们的最简单的试剂是( )
| A、盐酸 | B、水 |
| C、氢氧化钠溶液 | D、酒精 |
向27.2g Cu和Cu2O(物质的量之比为2:1)的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2.在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子恰好完全沉淀?下列有关说法错误的是( )
| A、混合物中Cu的物质的量为0.2 mol |
| B、产生的NO在标准状况下的体积为4.48L |
| C、硝酸的物质的量浓度为2.6mol/L |
| D、Cu?Cu2O与硝酸反应后剩余HNO3为0.2mol |
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A、K+、Cu2+、Na+、Cl- |
| B、SO42-、Na+、NO3-、CO32- |
| C、Na+、H+、NO3-、SO42- |
| D、Al3+、Na+、Cl-、SO42- |
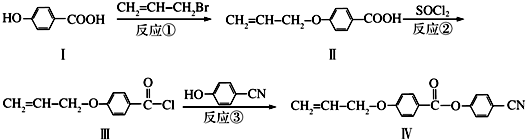
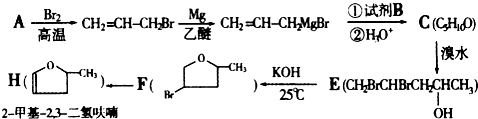
 也可与Ⅲ发生类似反应③的反应生成有机物V.V的结构简式是
也可与Ⅲ发生类似反应③的反应生成有机物V.V的结构简式是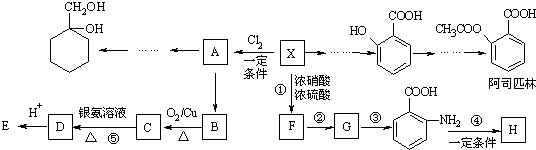
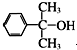
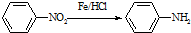 (苯胺,易被氧化)
(苯胺,易被氧化)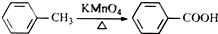
 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物有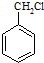 和其他无机物合成
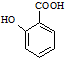
和其他无机物合成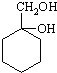 最合理的方案(不超过4步).例:
最合理的方案(不超过4步).例:
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空: