题目内容
六种元素的性质或结构信息如下表:
请回答下列问题:
(1)写出元素T形成的简单离子的电子排布式 ,R在元素周期表中的位置为 .
(2)Y、Z、W的电负性由大到小的顺序为 (填元素符号),Z的第一电离能高于元素周期表中相邻元素的原因: .
(3)X与W可形成一种既含离子键又含共价键的化合物,此化合物的电子式为 .
(4)室温下,Cu、R单质与Z的最高价氧化物的水化物的浓溶液组成原电池,其负极材料为 ;Cu、R单质与足量的Z的最高价氧化物的水化物的稀溶液组成原电池,其正极电极反应式为 .
(5)已知25℃、101kPa条件下:
①4T(s)+3W2(g)═2T2W3(s)△H=-2834.9kJ?mol-1;
②4T(s)+2W3(g)═2T2W3(s)△H=-3119.1kJ?mol-1.
则W2转化为W3的热化学方程式为: .
| 元素 | 原子结构和性质 |
| X | X原子在短周期中原子半径最大(稀有气体除外) |
| Y | 基态原子有3个不同的能级,各能级中电子数相等 |
| Z | 其气态氢化物与其最高价氧化物的水化物化合生成离子化合物 |
| W | 原子核外s能级电子总数等于p能级电子总数,能形成W2和W3两种单质 |
| T | 地壳含量最高的金属元素 |
| R | R的一种阳离子遇苯酚溶液显紫色 |
(1)写出元素T形成的简单离子的电子排布式
(2)Y、Z、W的电负性由大到小的顺序为
(3)X与W可形成一种既含离子键又含共价键的化合物,此化合物的电子式为
(4)室温下,Cu、R单质与Z的最高价氧化物的水化物的浓溶液组成原电池,其负极材料为
(5)已知25℃、101kPa条件下:
①4T(s)+3W2(g)═2T2W3(s)△H=-2834.9kJ?mol-1;
②4T(s)+2W3(g)═2T2W3(s)△H=-3119.1kJ?mol-1.
则W2转化为W3的热化学方程式为:
考点:位置结构性质的相互关系应用,热化学方程式,化学电源新型电池
专题:元素周期律与元素周期表专题
分析:X为短周期元素中原子半径最大的元素,应为第三周期ⅠA族元素,即Na元素;
Y的基态原子有3个不同的能级,各能级中电子数相等得出A是1s2 2s2 2p2,故Y为C元素;
Z的气态氢化物与其最高价氧化物的水化物化合生成离子化合物,故Z为N元素,离子化合物为铵盐;
W原子核外s能级电子总数等于p能级电子总数,能形成W2和W3两种单质,故W为O元素;
T是地壳含量最高的金属元素,故T为Al元素;
R的一种阳离子遇苯酚溶液显紫色,故R为Fe元素,据此解答各小题即可.
Y的基态原子有3个不同的能级,各能级中电子数相等得出A是1s2 2s2 2p2,故Y为C元素;
Z的气态氢化物与其最高价氧化物的水化物化合生成离子化合物,故Z为N元素,离子化合物为铵盐;
W原子核外s能级电子总数等于p能级电子总数,能形成W2和W3两种单质,故W为O元素;
T是地壳含量最高的金属元素,故T为Al元素;
R的一种阳离子遇苯酚溶液显紫色,故R为Fe元素,据此解答各小题即可.
解答:
解:依据分析可知:X为钠,Y为碳,Z为氮,W为氧,T为铝,R为铁,
(1)T为铝,Al易失去最外层的3个电子形成稳定结构,Al形成的简单离子的电子排布式为:1s22s22p6,Fe在元素周期表中的位置为:第四周期第ⅤⅢ族,故答案为:1s22s22p6;第四周期第ⅤⅢ族;
(2)元素的非金属性越强,其电负性越大,C、N、O的非金属强弱为:O>N>C,故电负性大小顺序为:O>N>C,元素的非金属性越强,其第一电离能越大,但是由于N元素的p轨道为半充满状态,故N的第一电离能大于O的第一电离能,故答案为:O>N>C;同周期相邻元素中N原子2p能级处于半充满状态,第一电离能高于同周期相邻元素,同主族元素中N元素原子半径最小,第一电离能最高;
(3)Na与O可形成一种既含离子键又含共价键的化合物为:过氧化钠,过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为: ,故答案为:
,故答案为: ;
;
(4)Cu、Fe单质与浓硝酸溶液组成原电池,Fe较低温度下,与浓硝酸发生钝化,故此时Cu与浓硝酸反应,所以负极材料为:Cu,与稀溶液反应时,稀硝酸的还原产物是NO,故电极反应方程式为:NO3-+4H++3e-═NO↑+2H2O,故答案为:Cu;NO3-+4H++3e-═NO↑+2H2O;
(5)已知25℃、101kPa条件下:
①4Al(s)+3O2(g)=2Al2O3(s)△H=-2834.9kJ/mol
②4Al(s)+2O3(g)=2Al2O3(s)△H=-3119.1kJ/mol
根据盖斯定律,则①-②得3O2(g)=2O3(g)△H=+284.2kJ/mol
则O2转化为O3的热化学方程式为:3O2(g)═2O3(g)△H=284.2kJ?mol-1,故答案为:3O2(g)═2O3(g)△H=+284.2kJ?mol-1.
(1)T为铝,Al易失去最外层的3个电子形成稳定结构,Al形成的简单离子的电子排布式为:1s22s22p6,Fe在元素周期表中的位置为:第四周期第ⅤⅢ族,故答案为:1s22s22p6;第四周期第ⅤⅢ族;
(2)元素的非金属性越强,其电负性越大,C、N、O的非金属强弱为:O>N>C,故电负性大小顺序为:O>N>C,元素的非金属性越强,其第一电离能越大,但是由于N元素的p轨道为半充满状态,故N的第一电离能大于O的第一电离能,故答案为:O>N>C;同周期相邻元素中N原子2p能级处于半充满状态,第一电离能高于同周期相邻元素,同主族元素中N元素原子半径最小,第一电离能最高;
(3)Na与O可形成一种既含离子键又含共价键的化合物为:过氧化钠,过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为:
 ,故答案为:
,故答案为: ;
;(4)Cu、Fe单质与浓硝酸溶液组成原电池,Fe较低温度下,与浓硝酸发生钝化,故此时Cu与浓硝酸反应,所以负极材料为:Cu,与稀溶液反应时,稀硝酸的还原产物是NO,故电极反应方程式为:NO3-+4H++3e-═NO↑+2H2O,故答案为:Cu;NO3-+4H++3e-═NO↑+2H2O;
(5)已知25℃、101kPa条件下:
①4Al(s)+3O2(g)=2Al2O3(s)△H=-2834.9kJ/mol
②4Al(s)+2O3(g)=2Al2O3(s)△H=-3119.1kJ/mol
根据盖斯定律,则①-②得3O2(g)=2O3(g)△H=+284.2kJ/mol
则O2转化为O3的热化学方程式为:3O2(g)═2O3(g)△H=284.2kJ?mol-1,故答案为:3O2(g)═2O3(g)△H=+284.2kJ?mol-1.
点评:本题主要考查结构性质位置关系、核外电子排布式、电离能、电负性、反应热计算等,题目较为综合,难度不大,注意对基础知识的全面掌握,注意(5)中盖斯定律的应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
澳大利亚科学家发现了纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性,下列叙述正确的是( )
| A、“碳纳米泡沫”与石墨互为同位素 |
| B、把“碳纳米泡沫”分散到适当的溶剂中,能产生丁达尔现象 |
| C、“碳纳米泡沫”是一种新型的碳化合物 |
| D、“碳纳米泡沫”和金刚石的性质相同 |
闪电时空气中的N2和O2会发生反应:N2(g)+2O2(g)═2NO2(g)△H=+180.50kJ/mol,△S=247.3J/(mol?K),若不考虑温度对该反应焓变的影响,则下列说法中正确的是( )
| A、在1 000℃时,此反应能自发进行 |
| B、在1 000℃时,此反应不能自发进行 |
| C、该反应能自发进行的最低温度约为730℃ |
| D、该反应能自发进行的最高温度约为730 K |
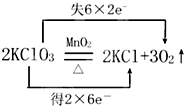 回答下列各题:
回答下列各题: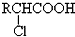 ;
;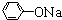 +RCl→NaCl+
+RCl→NaCl+