题目内容
X、Y、Z、D、E、G六种短周期元素的原子序数依次递增.X、Y、D元素的基态原子中电子层数与未成对电子数均相等;D、E属于同族元素,G的单质和ED2化合物均具有漂白性;R元素的M层全满,N层只有1个电子.
请回答下列问题:(用对应的元素符号表示)
(1)R元素在元素周期表分区中属于 区元素,Y、Z、D三种元素中电负性由小到大的顺序是 .
(2)X3D+的中心原子杂化轨道类型是 ,该离子的立体构型是 .
(3)向RED4的水溶液中加入ZX3的水溶液至过量,有关反应的离子方程式是 .
(4)向RG2的水溶液通入ED2,产生白色沉淀RG,该反应的离子方程式是 .
请回答下列问题:(用对应的元素符号表示)
(1)R元素在元素周期表分区中属于
(2)X3D+的中心原子杂化轨道类型是
(3)向RED4的水溶液中加入ZX3的水溶液至过量,有关反应的离子方程式是
(4)向RG2的水溶液通入ED2,产生白色沉淀RG,该反应的离子方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:D、E属于同族元素,G的单质和ED2均有漂白性,故G为Cl元素,ED2为SO2,即E为S,D为O,又X、Y、D元素元素原子中电子层数与未成对电子数均相等,X、Y、D原子序数依次递增,故X为H,Y为C,Z为N元素;R元素的M层全满,N层只有1个电子,则为Cu元素,据此解答各小题即可.
解答:
解:依据分析可知:X为氢、Y为碳、Z为氮、D为氧、E为硫、G为氯,R为铜,
(1)Cu位于周期表第4周期ⅠB族,外围电子构型为:3d104s1,属于ds区元素;同周期从左到右电负性依次增大,故C电负性小于N、N电负性小于O,故答案为:ds;C<N<O;
(2)水合氢离子中价层电子对个数=3+
(6-1-3×1)=4,且该微粒中含有一个孤电子对,所以水合氢离子为三角锥形,氧原子杂化方式为sp3;故答案为:sp3;三角锥形;
(3)硫酸铜和过量氨水反应先生成蓝色沉淀,后氢氧化铜溶解在氨水中生成络离子,得到深蓝色溶液,发生Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,故答案为:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
(4)二氧化硫有还原性,铜离子有氧化性,所以二氧化硫和氯化铜发生氧化还原反应生成氯化亚铜和硫酸,离子反应方程式为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+,故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+.
(1)Cu位于周期表第4周期ⅠB族,外围电子构型为:3d104s1,属于ds区元素;同周期从左到右电负性依次增大,故C电负性小于N、N电负性小于O,故答案为:ds;C<N<O;
(2)水合氢离子中价层电子对个数=3+
| 1 |
| 2 |
(3)硫酸铜和过量氨水反应先生成蓝色沉淀,后氢氧化铜溶解在氨水中生成络离子,得到深蓝色溶液,发生Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,故答案为:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
(4)二氧化硫有还原性,铜离子有氧化性,所以二氧化硫和氯化铜发生氧化还原反应生成氯化亚铜和硫酸,离子反应方程式为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+,故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+.
点评:本题综合考查原子核外电子排布、原子结构及分子的立体结构、物质成键情况,综合性较强,具有一定的难度.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、氯气通入水中:Cl2+H2O?2H++Cl-+ClO- |
| B、氢氧化铁胶体中加入HI溶液:Fe(OH)3+3H+=Fe3++3H2O |
| C、NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、用稀硝酸除去试管内壁银:3Ag+4H++NO3-=3Ag++NO↑+2H2O |
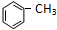 +Cl2
+Cl2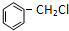 +HCl ②R-CH2-CH=CH2+Cl2
+HCl ②R-CH2-CH=CH2+Cl2
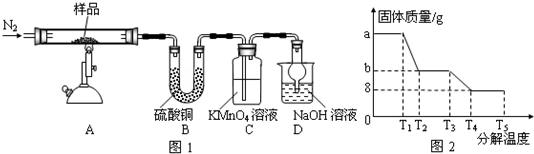
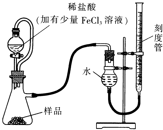 镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量.
镁(MgO2)易溶于稀酸,溶于酸后会产生过氧化氢,在医学上可作为“解酸剂”等.过氧化镁产品中常会混有一定量的MgO,实验室可通过多种方案测定样品中过氧化镁的含量.某研究小组拟用如图装置测定一定质量的样品中过氧化镁的含量.