题目内容
8.已知稀硝酸和稀硫酸组成的混酸中c(NO3-)+c(SO42-)=5mol•L-1,若取一定量的混酸溶解铜粉达到最大值(假设还原产物只有NO),则混酸中HNO3、H2SO4的物质的量浓度之比为( )| A. | 1:1 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
分析 稀硝酸和稀硫酸组成的混酸中c(NO3-)+c(SO42-)=5mol•L-1,稀硝酸和Cu反应但稀硫酸和Cu不反应,混酸和Cu反应离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,要使溶解的Cu最大,则硝酸根离子应该完全反应,根据离子方程式知,c(NO3-)、c(H+)=2:8=1:4,
设c(NO3-)=xmol/L、则c(H+)=4xmol/L,根据电荷守恒得c(NO3-)+2c(SO42-)=5mol/L×2-xmol/L+c(H+)=4xmol/L,x=2,
所以c(NO3-)=2mol/L、则c(H+)=8mol/L,c(SO42-)=5mol/L-2mol/L=3mol/L,
根据硝酸根离子守恒、硫酸根离子守恒计算混酸中HNO3、H2SO4的物质的量浓度之比.
解答 解:稀硝酸和稀硫酸组成的混酸中c(NO3-)+c(SO42-)=5mol•L-1,稀硝酸和Cu反应但稀硫酸和Cu不反应,混酸和Cu反应离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,要使溶解的Cu最大,则硝酸根离子应该完全反应,根据离子方程式知,c(NO3-)、c(H+)=2:8=1:4,
设c(NO3-)=xmol/L、则c(H+)=4xmol/L,根据电荷守恒得c(NO3-)+2c(SO42-)=5mol/L×2-xmol/L+c(H+)=4xmol/L,x=2,
所以c(NO3-)=2mol/L、则c(H+)=8mol/L,c(SO42-)=5mol/L-2mol/L=3mol/L,
根据硝酸根离子守恒、硫酸根离子守恒得c(NO3-)=c(HNO3)=2mol/L、c(SO42-)=c(H2SO4)=3mol/L,
所以混酸中HNO3、H2SO4的物质的量浓度之比2mol/L:3mol/L=2:3,
故选C.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生理解、分析、计算能力,明确反应中硝酸根离子与氢离子关系式是解本题关键,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| 时间/s | 20 | 40 | 60 | 80 | 100 |
| c(NO2 )/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
(1)20s内,v(NO2)=0.006mol•L-1•s-1.
(2)升高温度时,气体颜色加深,则正反应是吸热(填“放热”或“吸热”)反应.
(3)该温度下反应的化学平衡常数数值为1.8.
(4)相同温度下,若开始时向该容器中充入的是0.20molN2O4和0.40molNO2,则达到平衡后,c(NO2)=0.30mol/L.
| A. | 干燥的氯气可以贮存在钢瓶中 | |
| B. | 氯气是一种黄绿色的,强烈刺激性气味的有毒气体 | |
| C. | 工业上常用电解熔融氯化钠的方法制备氯气 | |
| D. | 氯气能给水进行消毒是因为氯气与水反应生成了HClO |
| A. | 2v正(B)=v逆(C) | B. | 该体系的密度都不随时间变化 | ||
| C. | 1molA断裂,同时1molC也断裂 | D. | 该体系的温度不随时间而变化 |
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间.
| 序号 | 反应温度/℃ | c(H2O2)/mol•L-1 | V(H2O2)/mL | m(MnO2)/g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
(2)为研究温度对化学反应速率的影响,可以将实验2和实验4(填序号)作对比.
(3)将实验1和实验2作对比,t1>t2(填“>”、“<”或“=”).
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-═2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:①0.1mol•L-1 KI溶液 ②0.1mol•L-1 FeCl3溶液
③0.1mol•L-1 FeCl2溶液 ④0.1mol•L-1 盐酸
⑤0.1mol•L-1 KSCN溶液 ⑥CCl4
实验步骤:(1)取5mL 0.1mol•L-1 KI溶液,再滴加几滴0.1mol•L-1 FeCl3溶液
(2)充分反应后,将溶液分成三份
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘
(4)另取一份,加试剂⑤(填序号),现象溶液显血红色,说明此反应存在一定的限度.
Ⅲ.N2O4可分解为NO2.在100mL密闭容器中投入0.01mol N2O4,利用现代化学实验技术跟踪测量c(NO2),c(NO2)随时间变化的数据记录如图所示.
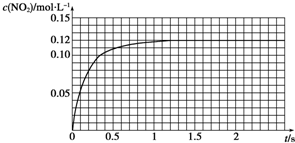
①反应容器中最后剩余的物质有N2O4和NO2,其中N2O4的物质的量为0.004mol.
②c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,从开始到平衡建立这段时间的平均反应速率为0.1mol/(L.s).
