题目内容
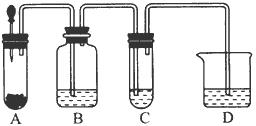 小明在阅读《化学课外补充材料(高一)》时,注意到该书中的下列描述:浓盐酸和次氯酸钙能发生反应并产生氯气,反应为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.小明设计了如图的装置验证上述反应原理.(已知:胶头滴管中装浓盐酸)
小明在阅读《化学课外补充材料(高一)》时,注意到该书中的下列描述:浓盐酸和次氯酸钙能发生反应并产生氯气,反应为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.小明设计了如图的装置验证上述反应原理.(已知:胶头滴管中装浓盐酸)A.试管装次氯酸钙;
B.广口瓶装饱和食盐水;
C.试管装KI淀粉溶液;
D.烧杯装饱和石灰水.
问题:若产生标准状况下Cl2 11.2L,则反应过程中转移的电子数为
考点:氧化还原反应的计算
专题:计算题
分析:根据n=
计算出标况下11.2L氯气的物质的量,然后根据反应Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O中化合价变化计算出转移的电子数、被氧化的还原剂的物质的量.
| V |
| 22.4L/mol |
解答:
解:标况下11.2L氯气的物质的量为:n(Cl2)=
=0.5mol,
反应Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O中,Ca(ClO)2中氯元素的化合价为+1价,反应后生成0价的氯气,生成2mol氯气注意的电子的物质的量为:(1-0)×2mol=2mol,则生成0.5mol氯气转移电子的物质的量为:2mol×
=0.5mol,转移的电子数为:N=nNA=0.5NA;
该反应中还原剂为氯化氢,生成2mol氯气时被氧化的HCl的物质的量为2mol,则生成0.5mol氯气时被氧化的HCl的物质的量为:0.5mol×
=0.5mol,
故答案为:0.5NA;0.5mol.
| 11.2L |
| 22.4L/mol |
反应Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O中,Ca(ClO)2中氯元素的化合价为+1价,反应后生成0价的氯气,生成2mol氯气注意的电子的物质的量为:(1-0)×2mol=2mol,则生成0.5mol氯气转移电子的物质的量为:2mol×
| 0.5mol |
| 2mol |
该反应中还原剂为氯化氢,生成2mol氯气时被氧化的HCl的物质的量为2mol,则生成0.5mol氯气时被氧化的HCl的物质的量为:0.5mol×
| 2mol |
| 2mol |
故答案为:0.5NA;0.5mol.
点评:本题考查了氧化还原反应的计算,题目难度不大,明确氧化还原反应中化合价变化为解答关键,注意掌握氧化剂、氧化产物、还原剂、还原产物的概念及判断方法,试题侧重基础知识的考查,有利于培养学生的分析、理解能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
与有机物 互为同分异构体,且能与NaOH 溶液反应的化合物有( )
互为同分异构体,且能与NaOH 溶液反应的化合物有( )
 互为同分异构体,且能与NaOH 溶液反应的化合物有( )
互为同分异构体,且能与NaOH 溶液反应的化合物有( )| A、7种 | B、8种 | C、9种 | D、10种 |
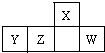 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A、原子半径:X>Y>Z>W |
| B、Y、Z是金属元素 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |
 硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下:
硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小.实验室中常以废铁屑为原料来制备,其步骤如下:
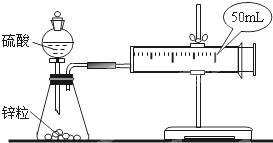 两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间.
两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间. 低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.
低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.