题目内容
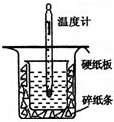 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题(1)从如图实验装置看,其中尚缺少的一种玻璃用品是
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热数值会
(3)实验中改用60mL 0.50mol?L-1盐酸跟50mL 0.55mol?L-1 NaOH溶液进行反应,与上述实验相比,所求中和热
简述理由:
(4)某实验小组用盐酸和氢氧化钠溶液做了三次实验,每次取溶液各50mL,并记录下原始数据:
| 实验序号[来源:学#科#网] | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
| 3 | 25.1 | 25.1 | 25.1 | 27.1 | 2.0 |
考点:中和热的测定
专题:
分析:(1)根据量热计的构造来判断该装置的缺少仪器;为了减少热量的损失,大烧杯杯口与小烧杯杯口相平,两烧杯之间塞满碎泡沫塑料;大烧杯上如不盖硬纸板,会使一部分热量散失;
(2)醋酸是弱酸,电离过程需要吸热;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)先根据Q=m?c?△T计算反应放出的热量,然后根据△H=-
kJ/mol计算出反应热;
(2)醋酸是弱酸,电离过程需要吸热;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)先根据Q=m?c?△T计算反应放出的热量,然后根据△H=-
| Q |
| n |
解答:
解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;为了减少热量的损失,大烧杯杯口与小烧杯杯口相平,两烧杯之间塞满碎泡沫塑料;大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小,
故答案为:环形玻璃搅拌器;大烧杯杯口与小烧杯杯口没有相平,两烧杯之间没有塞满碎泡沫塑料;
(2)醋酸是弱酸,电离过程需要吸热,所以测得的中和热数值会偏小;
故答案为:偏小;
(3)反应放出的热量和所用酸以及碱的量的多少有关,60mL 0.50mol?L-1盐酸跟50mL 0.55mol?L-1 NaOH溶液进行反应,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;
故答案为:相等;热的均是强酸和强碱反应生成1mol水时放出的热,和酸碱的用量无关;
(4)50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为前两次实验的平均值3.4℃,第三次数据错误,删去,则生成0.025mol水放出的热量为Q=m?c?△T=100g×4.18J/(g?℃)×3.4℃=1421.2J,即1.421kJ,所以实验测得的中和热△H=-
=-56.85 kJ/mol,该中和反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-56.85kJ/mol,故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l);△H=-56.85kJ/mol.
故答案为:环形玻璃搅拌器;大烧杯杯口与小烧杯杯口没有相平,两烧杯之间没有塞满碎泡沫塑料;
(2)醋酸是弱酸,电离过程需要吸热,所以测得的中和热数值会偏小;
故答案为:偏小;
(3)反应放出的热量和所用酸以及碱的量的多少有关,60mL 0.50mol?L-1盐酸跟50mL 0.55mol?L-1 NaOH溶液进行反应,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;
故答案为:相等;热的均是强酸和强碱反应生成1mol水时放出的热,和酸碱的用量无关;
(4)50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为前两次实验的平均值3.4℃,第三次数据错误,删去,则生成0.025mol水放出的热量为Q=m?c?△T=100g×4.18J/(g?℃)×3.4℃=1421.2J,即1.421kJ,所以实验测得的中和热△H=-
| 1.421kJ |
| 0.025mol |
点评:中和热的测定与计算,题目难度中等,注意理解中和热的概念是解题的关键.

练习册系列答案
相关题目
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A、与NaOH反应的氯气一定为0.3 mol |
| B、若反应中转移的电子为n mol,则0.15<n<0.25 |
| C、n(Na+):n(Cl-)可能为7:3 |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为8:2:1 |
关于分散系和胶体的说法正确的是( )
| A、胶体、溶液、浊液都是分散系 |
| B、粒子的半径:浊液>溶液>胶体 |
| C、可见光通过溶液时,产生丁达尔现象 |
| D、胶体都不透明,且稳定性极强 |
设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A、标准状况下,2.24LCH4所含质子数为0.1NA |
| B、0.1mol Fe与足量氯气反应转移的电子数为0.2NA |
| C、0.1mol C8H18分子中共价键总数为2.5NA |
| D、100mL 1mol/L醋酸溶液中离子总数为0.2NA |
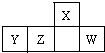 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A、原子半径:X>Y>Z>W |
| B、Y、Z是金属元素 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |
现有AgNO3、Na2CO3和 Na2SO4三种无色溶液,只用一种试剂,一次区别开,则该试剂是( )
| A、BaCl2溶液 |
| B、稀盐酸 |
| C、KOH溶液 |
| D、NaNO3溶液 |
下列说法中正确的是( )
| A、0.1mol/L (NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=4的醋酸稀释l0倍,溶液中c(CH3COOH)、c(OH-)均减小 |
| C、常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)=c(CH3COO-) |
| D、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |

 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: