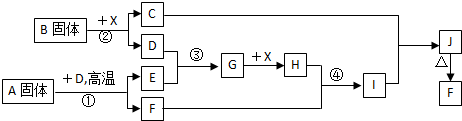
题目内容
已知:HCl(aq)与NaOH(aq)反应的△H=-55.6kJ/mol; HCN(aq)与NaOH(aq)反应的△H=-12.1kJ/mol.则HCN在水溶液中电离的△H等于( )
| A、+43.5 kJ/mol |
| B、-67.7 kJ/mol |
| C、+67.7 kJ/mol |
| D、-43.5 kJ/mol |
考点:用盖斯定律进行有关反应热的计算
专题:
分析:HCN(aq)与NaOH(aq)反应可分为两步:①HCN在水溶液中电离HCN H++CN;②产生的H+与NaOH(aq)反应;利用盖斯定律进行计算,可得HCN在水溶液中电离的反应热.
H++CN;②产生的H+与NaOH(aq)反应;利用盖斯定律进行计算,可得HCN在水溶液中电离的反应热.
 H++CN;②产生的H+与NaOH(aq)反应;利用盖斯定律进行计算,可得HCN在水溶液中电离的反应热.
H++CN;②产生的H+与NaOH(aq)反应;利用盖斯定律进行计算,可得HCN在水溶液中电离的反应热.解答:
解:反应的热化学方程式分别为:
HCN(aq)+OH-(aq)═CN-(aq)+H2O(l)△H=-12.1kJ?mol-1…①
H+(aq)+OH-(aq)═H2O(l)△H=-55.6kJ?mol-1…②
用①-②可得HCN电离的热化学方程式为:HCN(aq) H+(aq)+CN-(aq)△H=-12.1kJ?mol-1-(-55.6kJ?mol-1)=+43.5kJ?mol-1,
H+(aq)+CN-(aq)△H=-12.1kJ?mol-1-(-55.6kJ?mol-1)=+43.5kJ?mol-1,
故选:A.
HCN(aq)+OH-(aq)═CN-(aq)+H2O(l)△H=-12.1kJ?mol-1…①
H+(aq)+OH-(aq)═H2O(l)△H=-55.6kJ?mol-1…②
用①-②可得HCN电离的热化学方程式为:HCN(aq)
 H+(aq)+CN-(aq)△H=-12.1kJ?mol-1-(-55.6kJ?mol-1)=+43.5kJ?mol-1,
H+(aq)+CN-(aq)△H=-12.1kJ?mol-1-(-55.6kJ?mol-1)=+43.5kJ?mol-1,故选:A.
点评:本题考查反应热的计算,本题难度不大,做题时注意盖斯定律的应用.

练习册系列答案
相关题目
关于分散系和胶体的说法正确的是( )
| A、胶体、溶液、浊液都是分散系 |
| B、粒子的半径:浊液>溶液>胶体 |
| C、可见光通过溶液时,产生丁达尔现象 |
| D、胶体都不透明,且稳定性极强 |
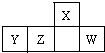 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A、原子半径:X>Y>Z>W |
| B、Y、Z是金属元素 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |
现有AgNO3、Na2CO3和 Na2SO4三种无色溶液,只用一种试剂,一次区别开,则该试剂是( )
| A、BaCl2溶液 |
| B、稀盐酸 |
| C、KOH溶液 |
| D、NaNO3溶液 |
H2SO4和HNO3的浓度分别为4mol/L和2mol/L的混合液,取10mL加入过量的铁粉,若HNO3的还原产物为NO,则生成气体在标况下的总体积为( )
| A、0.224L |
| B、0.672L |
| C、0.112L |
| D、0.336L |
下列说法中正确的是( )
| A、0.1mol/L (NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=4的醋酸稀释l0倍,溶液中c(CH3COOH)、c(OH-)均减小 |
| C、常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)=c(CH3COO-) |
| D、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4L酒精含有的分子数约为1NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA |
| C、通常状况下,1NA个CO2分子占有的体积为22.4L |
| D、1NA氧原子的质量(以g为单位)在数值上约等于其相对原子质量 |
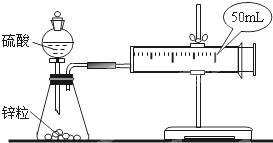 两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间.
两套如图所示装置,各盛有2g锌粒(颗粒大小相同)分别加入40ml 1mol/L和40ml 4mol/L的硫酸,比较二者收集10ml H2时所用的时间.