题目内容
某同学在做中和热的测定实验时,有些操作不规范,造成测得中和热的数值偏高,请你分析可能的原因( )
| A、测量盐酸的温度后,温度计没有用水冲洗干净 |
| B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 |
| C、量取盐酸时仰视读数 |
| D、将50 mL 0.55 mol/L氢氧化钠溶液取成了50 mL0.55 mol/L的氨水 |
考点:中和热的测定
专题:实验评价题
分析:中和热是强酸和强碱反应生成1mol水时放出的热量,依据Q=m?c?△T来逐项分析;
A.温度计没有用水冲洗干净,热量散失,导致反应后的温度低;
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失;
C.量取盐酸的体积时仰视读数,导致放出的热量多;
D.一水合氨是弱碱,碱的电离是吸热.
A.温度计没有用水冲洗干净,热量散失,导致反应后的温度低;
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失;
C.量取盐酸的体积时仰视读数,导致放出的热量多;
D.一水合氨是弱碱,碱的电离是吸热.
解答:
解:A.测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小,故A错误;
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,实验测得中和热的数值偏小,故B错误;
C.在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,酸过量,可以保证碱全反应,但参加反应的酸碱量增多,会使得中和和热的测定数据偏高,故C正确;
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水,由于一水合氨是弱碱,碱的电离是吸热的过程,所以导致实验测得中和热的数值偏小,故D错误;
故选C.
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,实验测得中和热的数值偏小,故B错误;
C.在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,酸过量,可以保证碱全反应,但参加反应的酸碱量增多,会使得中和和热的测定数据偏高,故C正确;
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水,由于一水合氨是弱碱,碱的电离是吸热的过程,所以导致实验测得中和热的数值偏小,故D错误;
故选C.
点评:本题考查中和热的测定,题目难度不大,实验的关键是保温,如果装置有能量散失,则会导致结果偏低,量取盐酸时仰视读数,会使得实际量取体积高于所要量的体积,会使得中和和热的测定数据偏高,注意抓住测定原理Q=m?c?△T即可完成测定反应热的误差问题.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
晚自习的课间,同学们站在学校4楼上,可以看到在容桂街道的空中有移动的光柱,这就是气溶胶中发生的丁达尔现象,下列分散系不能发生丁达尔现象的( )
| A、豆浆 |
| B、Fe(OH)3胶体 |
| C、食盐水 |
| D、烟、云、雾 |
用电石浆(主要成分是CaO、SiO2、Al2O3、Fe2O3、MgO、CaS 和其它不溶于酸的物质)生产无水CaCl2,工艺流程如下(已知氯化钙晶体的化学式是:CaCl2?6H2O),下列有关说法不正确的是( )
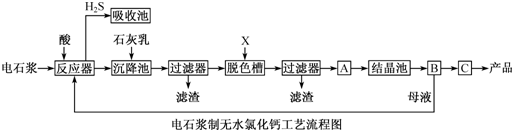

| A、反应器中加入的酸只能是盐酸 |
| B、脱色槽中应加入的X是为了脱色,所以可以选择活性炭或者过氧化钠 |
| C、氯化钙晶体CaCl2?6H2O可以直接脱水干燥得到无水CaCl2,无需在氯化氢的氛围下进行 |
| D、对设备B中产生的母液重新引入反应器,可以降低废弃物排放量,提高经济效益 |
 原子序数依次增大的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期.已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素中形成的单质中熔点最高;W原子核外的未成对电子数是前四周期元素中最多的.请回答下列问题:
原子序数依次增大的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期.已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素中形成的单质中熔点最高;W原子核外的未成对电子数是前四周期元素中最多的.请回答下列问题: